Полярный протонный растворитель
Cтраница 1
Полярные протонные растворители легко сольватируют как анионы, так и катионы. Неорганические катионы взаимодействуют со свободными электронными парами, тогда как анионы сольватируются путем образования водородных связей. В этих растворителях имеет место высокая степень диссоциации на свободные сольватированные ионы. Однако многие анионы обладают относительно низкой реакционноспособностью ( нуклеофильностью) из-за сильного экранирования сольватной оболочкой. [1]
Полярные протонные растворители за счет водородных связей сольва-тируют нуклеофил-анион и понижают тем самым его энергию и реакционную способность. [2]
В полярных протонных растворителях ( например, в воде или спирте), напротив, эти ионы образуют с молекулами растворителя водородные связи, благодаря чему нуклеофильные реагенты действуют как акцепторы; их нуклеофильность снижается на величину, равную этому взаимодействию, в результате чего затрудняется нуклеофильная атака субстрата. [3]
Сильно сольватирующие полярные протонные растворители ( вода, первичные спирты, муравьиная кислота) стабилизируют анионы и карбениевые ионы, благоприятствуя тем самым протеканию мономолекулярных реакций. [4]
Енолизация в полярных протонных растворителях начинается с протонирования О-атома карбонильной группы. [5]
 |
Относительная кислотность метанола и воды [ в газовой фазе ( а метанол является более кислым. в полярном растворе ( б вода является более кислой ]. [6] |
Если теперь поместить молекулы в полярный протонный растворитель, оба аниона, безусловно, будут стабилизированы вследствие сольватации. Меньший анион должен лучше сольватироваться за счет действия электростатических сил. Кроме того, водородные связи с растворителем стабилизируют орбитали неподеленных пар кислорода и ослабляют двухэлектрон-ный эффект, вызывающий релаксацию изолированных метилзамещенных ионов. Оба этих эффекта стабилизируют небольшие, менее замещенные ионы в большей степени, чем большие ионы с объемистыми заместителями. Следовательно, в растворе вода является более кислой, чем метанол. В этом случае решающая роль принадлежит двухэлектронным взаимодействиям между орби-талью тгсн и антисвязывающими орбиталями тройной связи. [7]
Трифторуксусная кислота используется иногда как полярный протонный растворитель. [8]
Реакции SN1 протекают преимущественно в полярных протонных растворителях с высокой ионизирующей способностью. Вода обладает наибольшей ионизирующей способностью и обеспечивает максимальную скорость гидролиза и сольволиза. Однако многие галогенпроизводные не растворяются в воде. Поэтому в реакциях SN1 чаще всего в качестве растворителя применяют муравьиную и уксусную кислоты, метиловый и этиловый спирты или их водные растворы. [9]
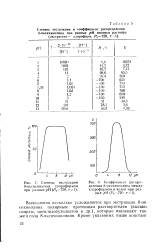 |
Степень экстракции 8-оксихинолина хлороформом при разных рН ( Р0720 /..| Коэффициент распределения 8-оксихинолина между хлороформом и водой при разных р ( Я., 720, г 1. [10] |
Вычисления несколько усложняются при экстракции 8-оксихинолина полярным протонным растворителем ( высшие спирты, метилизобутилкетон и др.), которые извлекают также и соли 8-оксихинолнния. [11]
Вычисления несколько усложняются при экстракции 8-оксихинолина полярным протонным растворителем ( высшие спирты, метилизобутилкетон и др.), которые извлекают также и соли 8-оксихинолина. [12]
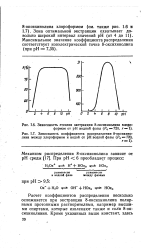 |
Зависимость коэффициента распределения 8-оксихинолина между хлороформом и водой от рН водной фазы ( Р0 720. [13] |
Расчет коэффициентов распределения несколько осложняется при экстракции 8-оксихинолина полярными протонными растворителями, например высшими спиртами, которые извлекают также и соли 8-ок-сихинолиния. [14]
Солеобразные нуклеофильные реагенты лучше всего растворяются в воде, которая является полярным протонным растворителем. Однако в воде плохо растворяется большинство органических соединений, в том числе галогенпроизводные. [15]
Страницы: 1 2