Расход - иод
Cтраница 1
Расход иода; 7 940 - 6.180 1 760 мл; при / % 1 020 это соответствует 1 760 - 1 020 1 795 мл точно 0.02 раствора иола. [1]
 |
Ксантогенат-иодные числа и температуры плавления ксантогенатов спиртов. [2] |
Расход иода в миллиграммах пересчитывается на 1 г ксантогената. [3]
По расходу иода можно определить содержание натрия и тем самым приблизительно установить степень этерификации. Однако при растворении ксантогената в растворе щелочи может произойти его частичный гидролиз, вследствие чего могут получиться заниженные значения степени этерификации. [4]
По расходу иода определяют содержание серы в анализируемом металле. [5]
Чем больше расход иода, тем выше содержание натрия в препарате и тем выше у ксантогената. [6]
Чем больше расход иода, тем выше содержание натрия в препарате и тем выше - f ксантогената. [7]
При этом измеряется расход иода. [8]
Наиболее эффективным способом снижения расхода иода является подача в зону реакции кислорода. [9]
Тиосульфат титруют иодом в присутствии крахмала; по расходу иода рассчитывают содержание тиосульфата. [10]
Содержимое всех промывалок сливают вместе, и определяют по расходу иода содержание SO2, по расходу щелочи - общую кислотность. [11]
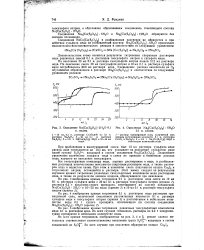 |
Окисление Nas [ Cu ( S2O3 2 6Н2О н. иодом. [12] |
Дальнейшее увеличение количества сульфата меди в смеси не приводит к изменению расхода иода, идущего на окисление тиосульфата. [13]
Количество глутатиона может быть вполне точно определено иодометри-ческим путем, так как расход иода значительно меньше зависит от условий титрования, нежели в случае цистеина ( см. стр. Количество израсходованного иода соответствует теоретическому, если реакцию проводить при температуре ниже 25 и при рН меньше 5; с уменьшением концентрации расход иода на моль глутатиона повышается. [14]
Прямое приготовление из компонентов столь разбавленного реактива, по-видимому, практически невозможно вследствие быстрого расхода иода на побочные реакции. По наблюдениям авторов [70], реактив Фишера с водным эквивалентом 0 03 - 0 04 мг / см3 вполне устойчив, и если титр и меняется, то не в сторону уменьшения, а в сторону увеличения. Этот факт, вероятно, объясняется разложением иодистоводородной кислоты под действием света. Эти данные подтверждают сообщение Митчела и Смита [1], которые наблюдали самопроизвольную регенерацию отработанного реактива Фишера при его длительном стоянии. [15]
Страницы: 1 2 3