Значение - изменение - энтальпии
Cтраница 1
Значения изменений энтальпии ( Я 298 15 - - Я0) и ( Я Ткип - Я0) приведены в таблице 3.1 со ссылками на литературу. Они получены непосредственным суммированием по уровням энергии молекулярного водорода. [1]
 |
Стандартная энтальпия образования. [2] |
Значение изменения энтальпии зависит от температуры, физических состояний ( тв. [3]
Значение изменения энтальпии перехода газа из стандартного состояния в раствор равно значению теплоты растворения газового компонента с обратным знаком. Эта теплота выделяется при переходе компонента из стандартного состояния в равновесный с ним водный раствор. При дальнейшем повышении концентрации компонента в растворе, необходимой для достижения конечного состояния процесса ( гипотетического чистого компонента), энтальпия не меняется, поскольку принимается соблюдение закона Генри. [4]
Так как значения тепловых эффектов имеют знаки, обратные значениям изменений энтальпии ( - ДЯг), соответственно внутренней энергии ( - А. [5]
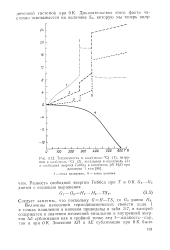 |
Теплоемкость в кал / ( моль С ( /, энтропия в кал / ( моль СС ( 2, энтальпия в ккал / моль ( 3 и свободная энергия Гиббса в ккал / моль ( 4 Н2О при давлении 1 атм. [6] |
Величины изменений термодинамических свойств льда I в точках плавления и кипения приведены в табл. 3.7, в которой содержатся и значения изменений энтальпии и внутренней энергии А. I-жидкость-пар, так и при О К. [7]
Для того чтобы отразить изменение энтальпии в реакции, тепловой эффект реакции не записывается, а рядом с химическим уравнением пишется значение изменения энтальпии. [8]
Затем на основании определяемых в пункте 1 данных о теплоемко-стях при 400, 500 и 600 К рассчитываются коэффициенты уравнения (11.13), как указано выше, и получают значения изменений энтальпии и энтропии, относящиеся к 400 К. К и дают новые значения уже для 500 К. Таким же образом последовательно вычисляются значения A. [9]
Затем на основании определяемых в пункте 1 данных о теплоемко-стях при 400, 500 и 600 К рассчитываются коэффициенты уравнения (11.13), как указано выше, и получают значения изменений энтальпии и энтропии, относящиеся к 400 К. Эти величины прибавляются к значениям для 400 К и дают новые значения уже для 500 К. Таким же образом последовательно вычисляются значения АЯ /, AS1 / 0 и lg Kp для более высоких температур, вплоть до 1000 К. [10]
Затем на основании определяемых в пункте 1 данных о теплоемко-стях при 400, 500 и 600 К рассчитываются коэффициенты уравнения (11.13), как указано выше, и получают значения изменений энтальпии и энтропии, относящиеся к 400 К. К и дают новые значения уже для 500 К. Таким же образом последовательно вычисляются значения A. [11]
 |
Значения теплоты сгорания1 некоторых горючих веществ при 25 С ( 298К. [12] |
Если предположить, что теплопотери в окружающую среду отсутствуют ( система является адиабатической), то количество выделенного тепла можно рассчитать по повышению температуры калориметра и его содержимого, теплоемкости которых точно известны. Значения изменений энтальпии ( ДН) и внутренней энергии ( ДУ) не совпадают, поскольку при постоянном давлении часть химической энергии затрачивается на выполнение работы ( РДУ) в процессе расширения. [13]
Изменение энтальпии, как функции состояния системы, представляет собой тепловой эффект реакции, измеренный при постоянном давлении, Qp - Дя А. Поскольку значение изменения энтальпии зависит от условий проведения химической реакции, вводится понятие стандартного состояния. Значение изменения энтальпии реакции, определенное при стандартном состоянии, называется стандартной. [14]
В отличие от изменений свободной энергии и энтропии при комплексо-образовании изменение энтальпии является унитарной величиной. Для нейтральных монодентатных лигандов значения изменений энтальпии составляют обычно от 0 до - 5 ккал / молъ, но могут достигать - 20 ккал / молъ для нейтральных полидентатных лигандов. [15]
Страницы: 1 2