Расход - титрованный раствор
Cтраница 2
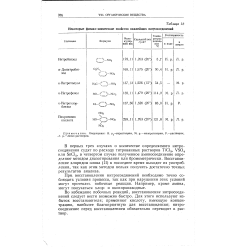 |
Некоторые физико-химические свойства важнейших нитросоединений. [16] |
В первых трех случаях о количестве определяемого нитро-соединения судят по расходу титрованных растворов TiCl3, VSO4 или SnCl2, в четвертом случае полученное аминосоединение определяют методом диазотирования или бромометрически. Восстановление хлоридом олова ( II) в последнее время выходит из употребления, так как этим методом нельзя получить достаточно точных результатов анализа. [17]
 |
Некоторые физико-химические свойства важнейших нитросоединсний. [18] |
В первых трех случаях о количестве определяемого нитро-соединения судят по расходу титрованных растворов TiClg, VSO4 или SnCl2, в четвертом случае полученное аминосоединение определяют методом диазотирования или бромометрически. Восстановление хлоридом олова ( II) в последнее время выходит из употребления, так как этим методом нельзя получить достаточно точных результатов анализа. [19]
В случае осложнения процесса восстановления образованием окси - и хлорпроизводных аминов расход титрованного раствора восстановителя [ например, хлорида олова ( II) или хлорида титана ( III) ] значительно уменьшается, так как при побочных реакциях на восстановление нитрогруппы расходуется меньше водорода. [20]
Бюретки различают по ряду признаков: принципу действия, способу регистрации расхода титрованного раствора, степени автоматизации и др. Обычно в бюретках автоматизируют следующие операции: подачу титранта в аналитическую ячейку, изменение скорости подачи титранта при подходе к точке конца титрования, прекращение подачи раствора при достижении точки конца титрования, регистрацию количества израсходованного раствора, наполнение бюретки. [21]
В первом случае она зависит от размера взятой мерной колбы, во втором - от предполагаемого расхода титрованного раствора. [22]
В случае отклонения процесса восстановления ( 1) в сторону образования окси - и хлорпроизводных аминов ( 2 и 3) расход титрованного раствора восстановителя, например хлористого олова, треххлористого титана, значительно снижается, так как при побочных реакциях на восстановление нитрогруппы расходуется меньше водорода. [23]
Не надо переходить границы указанных концентраций кислот, потому что увеличение концентрации, в особенности серной кислоты ( в присутствии указанных количеств соляной), вызывает расход титрованного раствора. Если кислот взято больше, то перед титрованием раствор нужно соответственно сильнее разбавить, что не вредит точности определения. [24]
Если содержания Mg2 и Са2 сильно различаются между собой, тогда на определение суммы и на отдельное определение Са2 отбирают неодинаковые объемы водной вытяжки, но после титрования расход титрованного раствора обязательно приводят к равным объемам водной вытяжки. [25]
В колбу наливают в избытке титрованный раствор иода, слегка подкисляют разбавленной серной кислотой, прибавляют порцию анализируемой воды и оттитровывают обратно избыток иода титрованным раствором сульфита натрия. Расход титрованных растворов не отмечают, так как это значения не имеет. В результате получается раствор, в котором сульфид окислен до элементарной серы, сульфит - до сульфата, а тиосульфат-до тетратионата. Определяют тетратионат и по его содержанию вычисляют первоначальное содержание тиосульфата. [26]
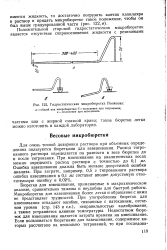 |
Гидростатическая микробюретка Полякова. [27] |
Для очень точной дозировки раствора при объемных определениях пользуются бюретками для взвешивания. Расход титрованного раствора определяется по разности в весе бюретки до и после титрования. [28]
В колбу наливают в избытке титрованный раствор иода, слегка подкисляют разбавленной серной кислотой, прибавляют порцию анализируемой воды и оттитровывают обратно избыток иода титрованным раствором сульфита натрия. Расход титрованных растворов не отмечают, так как это значения не имеет. Определяют тетратионат и по его содержанию вычисляют первоначальное содержание тиосульфата. [29]
Определение основано на трех йодометрических титрованиях. Расход титрованного раствора тиосульфата эквивалентен содержанию хлорита. [30]
Страницы: 1 2 3