Значение - константа - нестойкость
Cтраница 2
Значения констант нестойкости различных комплексных ионов колеблются в широких пределах и могут служить мерой устойчивости комплекса. [16]
Значения констант нестойкости комплексных ионов редкоземельных элементов - в рКп - приведены ниже. [17]
Значения констант нестойкости ЭДТА комплексов редкоземельных элементов, найденные авторами потенциометрическим методом, приведены ниже. [18]
Далее, значения констант нестойкости позволяют нам количественно охарактеризовать отмеченное в свое время Л. А. Чугаевым стабилизирующее действие циклических группировок. [19]
Упомянутыми способами определяются значения констант нестойкости, отвечающие полному распаду комплекса с освобождением центрального иона. [20]
К сожалению, значения констант нестойкости пока известны лишь для ограниченного числа комплексных соединений, производящихся от весьма различающихся по своей природе комплексообразователей. [21]
Если сравнить эти значения констант нестойкости с величинами, приведенными в табл. 1 и 4, то легко установить, что устойчивость комплексных соединений с урамилдиуксусной кислотой намного превосходит устойчивость комплексных соединений с остальными комплексонами и даже с нитрилотриуксусной кислотой. [22]
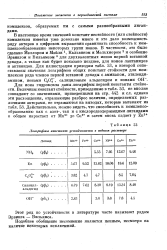 |
Логарифмы констант устойчивости в водном растворе. [23] |
В настоящее время значений констант нестойкости ( или стойкости) комплексов имеется уже довольно много и это дало возможность ряду авторов в цифровом выражении сравнивать способность к ком-плексообразованию некоторых групп ионов. В частности, это было сделано Меллором и Мэйли 1, Кальвином и Мельхиором 2 и особенно Эрвингом и Вильямсом 3 для двухвалентных ионов первой вставной декады, а также как будет показано позднее, для ионов лантанидов и актинидов. [24]
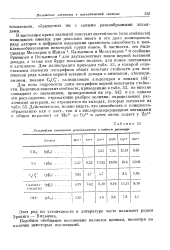 |
Логарифмы констант устойчивости в водном растворе. [25] |
В настоящее время значений констант нестойкости ( или стойкости) комплексов имеется уже довольно много и это дало возможность ряду авторов в цифровом выражении сравнивать способность к ком-плексообразованию некоторых групп ионов. В частности, это было сделано Меллором и Мэйли, Кальвином и Мельхиором 2 и особенно Эрвингом и Вильямсом 3 для двухвалентных ионов первой вставной декады, а также как будет показано позднее, для ионов лантанидов и актинидов. [26]
В табл. 1 приведены значения констант нестойкости комплексов, которые образует свинец с анионами ОЭИДА и гид-роксильными ионами. [27]
В табл. 1 представлены значения констант нестойкости комплексных соединений Ри ( III) с аминокислотами, рассчитанные по методу кривых относительного поглощения. [28]
Многие авторы при расчетах значений констант нестойкости комплексов, например для трехвалентного железа, исходят на значения нормального потенциала системы Реш / Реп, измеренного для ан 1 - Однако использование этого значения является не вполне законным, так как в среде IN HC1 ионы двух - и, особенно, трехвалентного железа будут находиться, в подавляющем количестве, в форме хлоридных комплексов. [29]
При переходе к другим растворителям значения констант нестойкости могут сильно меняться. [30]
Страницы: 1 2 3