Значение - константа - нестойкость
Cтраница 3
Действительно, из приведенных выше значений констант нестойкости следует, что концентрация простых ионов палладия в электролите настолько мала, что недостаточна для поддержания заметной скорости процесса осаждения палладия. Малые значения константы нестойкости указывают, что время существования ионов палладия в диссоциированном состоянии очень непродолжительно. Кроме того, ионное равновесие не может устанавливаться очень быстро, так как для распада молекул необходимо, чтобы в результате случайных столкновений частиц друг с другом их кинетическая энергия увеличивалась до значения распада, а вероятность этого, как видно из величины константы нестойкости, мала. [31]
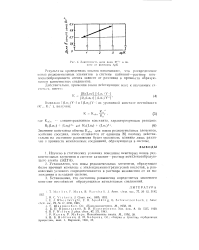 |
Зависимос П, доли иона Рг3 в ио-иите от величины ДрК. [32] |
Установлено, что состояние равновесия определяется значением констант нестойкости образующихся комплексных соединений. [33]
Проверьте, совпадает ли ответ со значениями констант нестойкости данных комплексных ионов. [34]
Ежовска-Тшебятовска, Пайдовский и Староста 41 нашли значения констант нестойкости для ряда гликоколевых производных трехвалентного хрома. За последнее десятилетие многими исследователями ( Монком 42 в Англии, Ли и Дуди 3 в США и другими) были получены количественные данные, характеризующие устойчивость комплексных соединений многих металлов с различными аминокислотами, а также дипептидами. [35]
Ежовска-Тшебятовска, Пайдовский и Староста 41 нашли значения констант нестойкости для ряда гликоколевых производных трехвалентного хрома. За последнее десятилетие многими исследователями ( Монком 42 в Англии, Ли и Дуди 43 в США и другими) были получены количественные данные, характеризующие устойчивость комплексных соединений многих металлов с различными аминокислотами, а также дипептидами. [36]
В зависимости от прочности связи между центральным ионом и лигандами значения констант нестойкости для разных ионов различны, но в большинстве случаев невелики. [37]
Сравним значение / CH [ Cuci4 ] z - со значением константы нестойкости одного из комплексных ионов меди, например / С [ си ( мн) 4р; 2 - Ю-13. Тогда мы увидим, что / CHfCuci1 ] - KH [ Cu ( NH3) 4 ] 2 на несколько порядков, а чем меньше константа нестойкости комплекса, тем больше его устойчивость. [38]
Из сказанного выше следует, что на основе приведенных в литературе значений констант нестойкости, вычисленных для водных растворов, не содержащих посторонних ионов, можно предусмотреть изменения значений потенциала и полноту связывания данного иона в комплекс только для водных растворов, содержащих потенциалопределяющие ионы и ионы-адденды. Cl -, SO /, то вычисленные константы нестойкости могут не соответствовать фактическим. При введении адденда в соляно - и сернокислые растворы вычисление констант нестойкости нереально. [39]
Из приведенных в табл. 1 - 4 данных видно, что найденные нами значения констант нестойкости для иона [ PdCl4 ] a - находятся в удовлетворительном согласии как с расчетными данными Латимера, так и с экспериментальными данными О. Полученная нами величина для иона [ PdBr4 ] 2 - отличается от расчетной величины ( Лати-мер [1]) приблизительно на три порядка. [40]
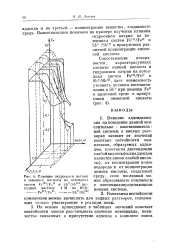 |
Влияние гидроокиси натрия и лимонной кислоты на потенциал систем Fe1II / Fo11 и Sbv / Sbni ( исходный раствор 1 М по НС1. - - - - - - - - - Sbv / Sbm. [41] |
Влияние аддендаани-она на поведение данной окислительно - восстановительной системы в кислых растворах зависит от значений констант нестойкости комплексов, образуемых адден-дом, константы диссоциации слабой кислоты ( если аддендом является анион слабой кислоты), от концентрации ионов водорода и от концентрации аниона кислоты, создающей среду, если последний может образовывать комплексы с потенциалопределяющими ионами системы. [42]
При изучении ком-плексообразования Ри ( IV) в этих растворах спектрофотомет-рическим методом авторы показали, что значение константы нестойкости негидролизованной формы комплекса равно 6 3 - Ю-25. [43]
Если учитывать все возможные гидратные формы, то построение количественной теории растворов электролитов становится практически невозможным из-за громоздкости формул и неопределенности значений констант нестойкости жидких гидратов. Поэтому в гидрат-ной теории растворов, развиваемой Г. И. Микулиным [3], принято для упрощения, что координационное число не изменяется во всем диапазоне концентраций, сохраняя свое значение, характерное для разбавленного раствора, процесс диссоциации жидких гидратов проходит не ступенчато, а сразу до свободного иона. Это допущение оправдывается тем, что неточность в выборе координационного числа компенсируется за счет константы нестойкости, а характер зависимости количества жидких гидратов от концентрации электролита почти не меняется. [44]
Таким образом, для установления у0 НА ( м) необходимо найти работу конденсации НА и работу растворения, а для определения YOHAM - еще и значение констант нестойкости и превращения. [45]
Страницы: 1 2 3