Значение - константа - равновесие
Cтраница 3
Значение константы равновесия зависит только от температуры и не зависит от других условий равновесия - давления, состава. Этот, очень важный термодинамический факт чрезвычайно сокращает экспериментальную работу, если, конечно, известны значения VLi-Vif ( P 1 Т) для химически заторможенных систем. [31]
 |
Значения Яу при различных давлениях. [32] |
Значение константы равновесия зависит от вида стехиометри-ческого уравнения реакции. [33]
Значения констант равновесия, определенные для этой системы при 37 78 и при 70 31 ата изображены кружками на рисунке. Линии, проведенные через кружки, воспроизводят изменения констант равновесия, полученные по уравнениям коэффициентов летучести, зависящих от мольной доли этилена в жидкости. [34]
Значения констант равновесия этих 1540 реакций можно рассчитать, сочетая соответствующим образом указанные в таблице данные для 56 электронных реакций; таким образом, эта небольшая таблица позволяет предсказать, в прямом или обратном направлении будет протекать любая из 1540 реакций. [35]
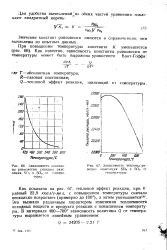 |
Зависимость констан.| Зависимость теплоты реакции окисления SC2 к SO3 от температуры. [36] |
Значения констант равновесия имеются в справочниках; они вычислены из опытных данных. [37]
 |
Из двух разных исходных состояний получена одинаковая равновесная смесь. в одном из них ( эксперимент 3 имеется только 0 400 М NO, а в другом ( эксперимент 4-только 0 0200 М N2O4. [38] |
Значение константы равновесия К можно вычислить по известным равновесным концентрациям всех реагентов и продуктов, участвующих в реакции. Такие данные можно получить непосредственно из экспериментальных измерений, подобно тому как это было сделано при составлении табл. 14.1. Наряду с этим равновесные концентрации можно вычислить по известным исходным концентрациям в начале реакции и по равновесной концентрации по крайней мере одного вещества. [39]
 |
Константы равновесия реакций. [40] |
Значения констант равновесия получены экстраполяцией данных Коуля А. [41]
Значения константы равновесия этих реакций и экспериментальные данные подтверждают, что восстановления ZnO и ZnS в указанном интервале температур не происходит. [42]
Значения констант равновесия для различных реакций приведены в справочных пособиях. [43]
 |
Расчет концентрации веществ для нестандартных условий II. [44] |
Значение константы равновесия, вычисленное по полученным равновесным концентрациям, совпадает со значением, вычисленным из термодинамических данных. Это указывает на правильность решения задачи. [45]
Страницы: 1 2 3 4 5