Значение - константа - равновесие - реакция
Cтраница 1
Значение константы равновесия реакции: SO2 - j - Va s SO3 взять из рис. 32; при расчете принять, что реакция достигает равновесного состояния. [1]
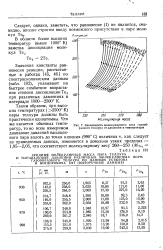 |
Зависимость молекулярного веса газообразного теллура от давления и температуры. [2] |
Значения константы равновесия реакции, рассчитанные в работах [45, 46] по спектроскопическим данным ( табл. 102), указывают на быстрое симбатное возрастание степени диссоциации Те 2 при различных давлениях в интервале 1000 - 2500 К. [3]
 |
Константы равновесия реакций гидродеалкилирования метилпроизводных ароматических углеводородов. [4] |
Значения констант равновесия реакций гидродеалкилирования, сопровождающихся отрывом метальных групп от моноциклических и бициклических ароматических углеводородов, показывают, что в интервале 227 - 627 С ( 500 - 900 К) эти реакции могут протекать практически нацело. [5]
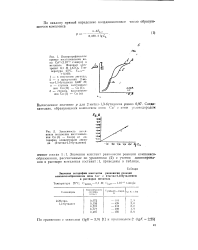 |
Зависимость потенциала полуволны восстановления Си ( I - Си ( о от логарифма концентрации лиганда ( 2-метил - 1 3-бутадиена. [6] |
Значения констант равновесия реакции комплексообразования, рассчитанные по уравнению ( 2) с учетом доминирования в растворе комплекса состава. [7]
 |
Константы равновесия реакций гидродеалкилирования метиллроизводных ароматических углеводородов. [8] |
Значения констант равновесия реакций гидродеалкилирования, сопровождающихся отрывом метальных групп от моноциклических и бициклических ароматических углеводородов, показывают, что в интервале 227 - 627 С ( 500 - 900 К) эти реакции могут протекать, практически нацело. [9]
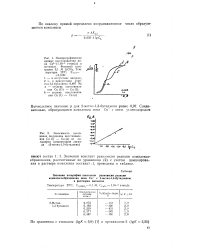 |
Зависимость потенциала полуволны восстановления Си ( I - Си ( о от логарифма концентрации лиганда ( 2-метил - 1 3-бутадиена. [10] |
Значения констант равновесия реакции комплексообразования, рассчитанные по уравнению ( 2) с учетом доминирования в растворе комплекса состава. [11]
Значения констант равновесия реакций полимеризации, стандартные отклонения и коэффициенты корреляций приведены ниже. [12]
Значения констант равновесия реакций образования веществ из простых соединений ( In К или lg K) приводятся в справочниках. [13]
Значения констант равновесия реакции водяного газа, применявшиеся при вычислениях, были следующие: 0 0143 при 283, 0 0217 при 810, 0 054 при 380 и 0 105 при 444 С. [14]
Значения констант равновесия реакций экстракции Bi различными катионооб-менными экстрагентами для наиболее широко используемых разбавителей приведены в табл. 3.5, из которой видно, что, в зависимости от природы экстрагента, значения gK меняются в широких пределах от - 2 8 для каприловой кислоты до 19 5 для ди-2 - этилгексилдитиофосфорной. [15]
Страницы: 1 2 3 4 5