Значение - константа - равновесие - реакция
Cтраница 2
Значение константы равновесия реакции окисления СО намного превышает значения констант равновесия других рассмотренных в данной главе реакций. Термодинамический расчет процесса показывает, что при температуре ниже 1500 С реакцию можно рассматривать как необратимую. Таким образом, методом избирательного окисления может быть достигнута очень высокая степень очистки азото-водородной смеси от окиси углерода. [16]
Значения констант равновесия реакции неполного окисления метана кислородом изменяются от 4 3 - 1013 при 400Э К до 1 5 - 10й при 1400 К. Эти значения настолько велики, что реакцию ( 9) можно считать практически необратимой. В связи с этим повышение концентрации кислорода в смеси метан - кислород сверх стехиометрического не дает увеличения выхода Н2 и СО. [17]
Пользуясь значениями констант равновесия реакций: 2NO О 2NO и 2SO2 О2 2SO3 ( см. приложение I, табл. 24): а) вывести температурную зависимость lg Кр для реакции SO NO2 NO SO3; б) определить, какое влияние оказывает давление на эту реакцию. [18]
Требуется определить значение константы равновесия реакции СН4 2О2 СО2 2Н2О при температуре 1200 К. [19]
Связано ли значение константы равновесия реакции с формой записи сте-хиометрического уравнения реакции. [20]
Требуется определить значение константы равновесия реакции горения метана в кислороде СН4 2О2 СО2 2Н2О при температуре 950 С. [21]
С ростом температуры значение константы равновесия реакции Н2О ( г.) Н2 ( г.) Va z ( г -) возрастает. [22]
С ростом температуры значение константы равновесия реакции Н2О ( г.) Н2 ( г.) / 2О2 ( г.) возрастает. [23]
 |
Константы равновесия реакций обмена между ацеталями и силоксанами. [24] |
Расчеты показывают, что значения констант равновесия реакций близки к статистическим только в случае обмена между соединениями одного класса. В табл. 1.11 приведены значения констант равновесия реакций обмена между ацеталями и силоксанами, полученные экспериментально и рассчитанные исходя из допущения случайного распределения заместителей. [25]
В табл. 7 приведены значения констант равновесия реакции Li2 2Li, полученные Гордоном [281], и вычисленный нами из этих значений на основании уравнений зависимости давления пара от температуры состав пара. [26]
 |
Кривые равновесия восстановления окислов железа водородом. [27] |
В реальных условиях на значения констант равновесия реакций восстановления окислов железа водородом влияние оказывает также дисперсность фаз. [28]
В табл. 49 приведены значения констант равновесия реакции образования С2Н2 из элементов и-феакшш СН4м 2Н2 ЗН2, а в габл. [29]
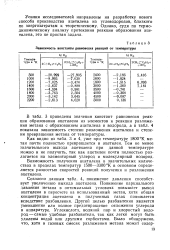 |
Зависимость константы равновесия реакций от температуры. [30] |
Страницы: 1 2 3 4 5