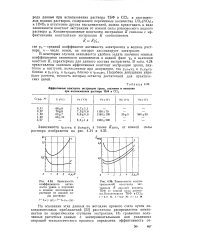
Значение - эффективная константа
Cтраница 2
Результаты, полученные нами при изучении влияния концентрации катализатора на скорость исследуемой реакции, показывают, что значение эффективной константы скорости прямо пропорционально квадрату общей концентрации бензолсульфокис-лоты. Из температурной зависимости константы скорости реакции была вычислена кажущаяся энергия активации процесса, значение которой оказалось равным 10 ккал / моль. [16]
Результаты, полученные нами при изучении влияния концентрации катализатора на скорость исследуемой реакции, показы вают, что значение эффективной константы скорости прямо пропорционально квадрату общей концентрации бензолсульфокис-лоты. Из температурной зависимости константы скорости реакции была вычислена кажущаяся энергия активации процесса, значение которой оказалось равным 10 ккал / моль. [17]
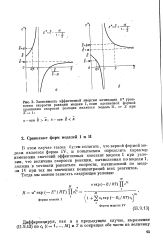 |
Зависимость эффективной энергии активации Е уравнения скорости реакции модели I, если адекватной формой уравнения скорости реакции является модель II, от Z при Z - 1. [18] |
В этом случае также будем полагать, что верной формой модели является форма IV, и попытаемся определить характер изменения значений эффективных констант модели I при условии, что величина скорости реакции, вычисляемая по модели. [19]
В отсутствие урана при кислотности до - 6 М DYV падает с температурой, что объясняется уменьшением константы распределения. Действительно, значения эффективных констант, найденные описанным выше методом, оказались равными К20 2600, / С. [20]
В некоторых случаях оказывается удобнее задать значения ионных коэффициентов активности компонентов в водной фазе у и значения констант Ж, характерных для данного состава экстрагента. В табл. 4.24 представлены значения эффективных констант экстракции урана, плутония и нептуния, вычисленные при допущении, что Y PU ( VD и Y NP ( VI близки к Y UVD, a Y NP ( IV близко к Y PU ( IVV Подобное допущение упрощает расчеты, точность которых остается достаточной для практических целей. [22]
 |
Состав сольватов соляной кислоты при экстракции ТБФ по данным, разных авторов. [23] |
Отсутствие надежных сведений о стехиометрии реакций и коэффициентах активности компонентов органической фазы затрудняет Количественное описание экстракции по гидратно-сольватно-му механизму. Поэтому термодинамические константы распределения обычно находят экстраполяцией значений эффективных констант в область бесконечно разбавленных растворов. Их используют в основном для определения коэффициентов активности распределяемого вещества в органической фазе. [24]
Найдены оптимальные условия получения моноциклопентиларенов при алкилировании бензола, толуола, этил - и изопропил-бензолов циклопентанолом в присутствии комплекса фтористого бора с полифосфорной кислотой. Определены соотношения констант образования моно - и дициклопентиларенов, вычислены значения эффективных констант скоростей реакции и энергия активации циклопентилирования бензола и его гомологов. [25]
Кинетику гомогенно-каталитических реакций обычно исследуют в периодических условиях, причем объем реакционной смеси остается все время практически постоянным. С целью упрощения кинетических уравнений и лучшего выбора альтернативных вариантов первые серии опытов часто проводят при одинаковой концентрации катализатора и большом избытке одного из реагентов, концентрации которых постоянны и могут вводиться в значения эффективных констант. [26]
Скорость катионной полимеризации аллил-9 - флуорени-лового эфира пропорциональна концентрации мономера в третьей степени ( в стадии инициирования участвуют две молекулы мономера) и концентрации катализатора ( хлорного олова) в первой степени. Реакция обрыва основана на взаимодействии макрокатиона с противоионом. Вычислите значения эффективной константы скорости инициирования и относительной конг станты скорости передачи цепи на мономер, если известно, что при температуре опыта ( 140 С) эффективная константа скорости полимеризации равна 1 28 10 - 4 л3 моль 3 с-1, концентрациям мономера 1 54, 2 27 и 3 12 моль-л 1 соответствуют среднечисловые степени полимеризации. Передача цепи на растворитель незначительна. [27]
Понятно, что в этом случае образование внутримолекулярной водородной связи в солях третичных аминов должно было бы привести к сдвигу Яшах, I - в длинноволновую область относительно положения полосы переноса заряда в спектрах иоди-дов симметричных четвертичных аммониевых оснований. Следовательно, увеличение энергии переноса заряда ( сдвиг полосы поглощения в коротковолновую область) при уменьшении степени замещения на атоме азота оснований свидетельствует в пользу уменьшения взаимодействия между иодид-ионом и катионом в этом ряду. По-видимому, это обусловлено использованием для сопоставления значений эффективных констант. [28]
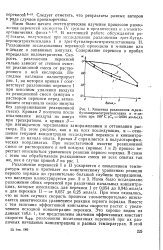 |
Кинетика разложения трет-бутилперокситриэтилсилана в к-де-кане при 180 С ( С0 0 054 моль. л. [29] |
При этом оказалось, что во всех случаях скорость процесса удовлетворительно описывается кинетическим уравнением реакции первого порядка. Вместе с тем величина эффективной константы скорости растет с увеличением исходной концентрации перекиси. Это хорошо видно из данных табл. 1, где представлены значения эффективных констант скорости йэфф. [30]
Страницы: 1 2 3