Значение - коэффициент - кристаллизация
Cтраница 1
Значение коэффициента кристаллизации D вычисляли как по формуле Хлопина, так и по формуле Дорнера - - Госкинса в зависимости от условий проведения опыта. Приведенные в таблице значения коэффициентов являются средними из 12 - 15 опытов, полученными как одним и тем же, так и различными методами. [1]
Уменьшение значения коэффициента кристаллизации при повышении температуры не является, по-видимому, характеристикой механизма соосаждения. [2]
Величина К совпадает с значением коэффициента кристаллизации D [5], если между кристаллами и раствором достигается истинное термодинамическое равновесие. [3]
 |
Зависимость D от природы плавня. [4] |
Таким образом, по изменению значения коэффициента кристаллизации микрокомпонента в определенных условиях можно судить не только о наличии комплексных соединений микро - и макрокомпонентов в расплаве, но и об их относительной прочности. [5]
Увеличение активности ионов макрокомпонента приводит к уменьшению значения коэффициента кристаллизации микрокомпонента, а уменьшение активности ионов макрокомпонента - к увеличению его значения. Соответствующие изменения активности ионов микрокомпонента приводят к обратному изменению значения коэффициента кристаллизации. [6]
 |
Зависимость D от природы плавня. [7] |
Однако наличие комплексного соединения в системе не всегда приводит к изменению значения коэффициента кристаллизации. Исследования, проведенные с системами КС1 - RbCl - ВаС12 и KG1 - RbCl - СаС12, в которых катионы макро - и микрокомпонентов ( ионы калия и рубидия) входят во внешнюю сферу образующихся в системе комплексных соединений ( КВаС13, КСаС13, RbBaClg и RbCaQ3), показали, что в этом случае не наблюдалось изменения значения коэффициента кристаллизации при изменении температуры и состава расплава. [8]
Таким образом становятся понятными приведенные выше экспериментальные данные, свидетельствующие об отсутствии простой связи между значениями коэффициентов кристаллизации и относительной растворимости изоморфных веществ. [9]
Подобные системы были подробно изучены Б. А. Никитиным [14] и Э. М. Иоффе [35], которые показали, что они подчиняются закону Хлопина в том смысле, что значение коэффициента кристаллизации для этих систем не зависит от соотношения объемов твердой и жидкой фаз. [10]
Сопоставление полученных данных по изучению влияния температуры, состава расплава, химической природы плавня, ком-плексообразования и разницы радиусов ионов микро - и макрокомпонентов на значение коэффициента кристаллизации микрокомпонента с результатами других авторов, изучавших различные физико-химические свойства этих же систем, позволило сделать вывод, что в расплавах существует также зависимость между изменением активности ионов макро - и микрокомпонентов в жидкой фазе и изменением значения коэффициента кристаллизации микрокомпонента, которая была установлена для случая кристаллизации изоморфных смешанных кристаллов из насыщенных водных растворов. [11]
Приведенные в таблице экспериментальные данные свидетельствуют о том, что, во-первых, замена хлористого натрия на хлористый кадмий и цинк привела к заметному уменьшению значения коэффициента кристаллизации радия при практически одинаковой температуре опыта, а, во-вторых, при 410 и ниже отсутствует сокристаллизация хлористого радия с хлористым свинцом. [12]
С увеличением ионного радиуса щелочного металла должна увеличиваться также и прочность комплексных соединений SrCl2, что должно приводить к уменьшению активности ионов микрокомпонента в расплаве и к уменьшению значения коэффициента кристаллизации. Однако проведенные исследования показали, что с увеличением ионного радиуса катиона растворителя наблюдается систематическое увеличение коэффициента кристаллизации микрокомпонента. [13]
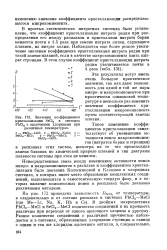 |
Значения коэффициентов. [14] |
Эти результаты могут иметь очень большое практическое значение, так как дают возможность для одной и той же пары микро - и макрокомпонентов при практически одинаковой температуре в несколько раз изменить значение коэффициента кристаллизации микрокомпонента путем соответствующей замены плавня. [15]
Страницы: 1 2 3