Значение - коэффициент - кристаллизация
Cтраница 2
При распределении разных микрокомпонентов между расплавом и кристаллами одного и того же макрокомпонента в одних и тех же условиях ( табл. 132) и при распределении одного и того же микрокомпонента между расплавом и кристаллами разных макрокомпонентов ( табл. 131) значение коэффициента кристаллизации тем больше, чем меньше разница радиусов ионов микро - и макрокомпонентов. [16]
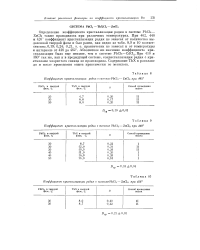
 |
Изменение молярных коэффициентов поглощения е и коэффициентов кристаллизации D. [17] |
Для меньших концентраций K2SO4 в растворе ( 0 2Af), где происходит уменьшение количеств иона Ри ( 5О4) и одновременно вместо KsLa ( SO4) 3 из раствора выпадает соль l La ( SO4) 2, авторы наблюдали аналогичную связь между значением коэффициента кристаллизации и составом соединения. [18]
Сопоставление полученных данных по изучению влияния температуры, состава расплава, химической природы плавня, ком-плексообразования и разницы радиусов ионов микро - и макрокомпонентов на значение коэффициента кристаллизации микрокомпонента с результатами других авторов, изучавших различные физико-химические свойства этих же систем, позволило сделать вывод, что в расплавах существует также зависимость между изменением активности ионов макро - и микрокомпонентов в жидкой фазе и изменением значения коэффициента кристаллизации микрокомпонента, которая была установлена для случая кристаллизации изоморфных смешанных кристаллов из насыщенных водных растворов. [19]
Очень большое влияние на процесс распределения церия и иттрия во фторидных системах имеет газовая среда. Уменьшение значений коэффициентов кристаллизации в кислороде и углекислом газе может быть объяснено химическим взаимодействием этих газов с микрокомпонентами, приводящим к образованию фторокисей церия и иттрия в кислороде и карбонатных комплексных соединений в углекислом газе. [20]
Абсолютное же значение коэффициента кристаллизации было еще меньше, чем в системе РЬСЬ-CdCl2. [22]
Зависимость захвата европия осадкой оксалата тория от концентрации ионов тория была исследована методом изотермического снятия пересыщения. В табл. 1 приведены значения коэффициентов кристаллизации европия, полученные на основании нескольких экспериментов с различной концентрацией тория в исходном пересыщенном растворе и при практически постоянной концентрации оксалатных ионов, обеспечиваемой значительным избытком щавелевой кислоты во отношению к торию. [23]
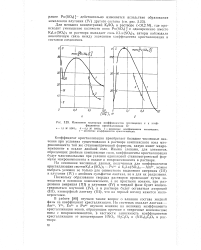
В простых эвтектических нитратных системах было установлено, что коэффициент кристаллизации нитрата радия при распределении его между расплавом и кристаллами нитрата бария меняется почти в 1.5 раза при замене нитрата лития, служащего плавнед. Наблюдается еще более резкое увеличение значения коэффициента кристаллизации нитрата радия при такой замене плавней, если в качестве макрокомпонента взять нитрат стронция. [24]
 |
Зависимость D от природы плавня. [25] |
Это объяснено тем, что в расплаве происходит практически полная электролитическая диссоциация образующегося соединения на простые катионы и комплексные анионы. Полученные результаты показывают, что влияние образования соединения на значение коэффициента кристаллизации зависит не только от прочности этого соединения, но и от местонахождения ионов микро - и макрокомпонентов в этом соединении. [26]
Увеличение активности ионов макрокомпонента приводит к уменьшению значения коэффициента кристаллизации микрокомпонента, а уменьшение активности ионов макрокомпонента - к увеличению его значения. Соответствующие изменения активности ионов микрокомпонента приводят к обратному изменению значения коэффициента кристаллизации. [27]
 |
Зависимость D от природы плавня. [28] |
Однако наличие комплексного соединения в системе не всегда приводит к изменению значения коэффициента кристаллизации. Исследования, проведенные с системами КС1 - RbCl - ВаС12 и KG1 - RbCl - СаС12, в которых катионы макро - и микрокомпонентов ( ионы калия и рубидия) входят во внешнюю сферу образующихся в системе комплексных соединений ( КВаС13, КСаС13, RbBaClg и RbCaQ3), показали, что в этом случае не наблюдалось изменения значения коэффициента кристаллизации при изменении температуры и состава расплава. [29]
Распределение радона между газовой и кристаллической фазами подчиняется закону Хлопина. Это показывает, что в данном случае имеет место истинное термодинамическое равновесие между газовой и вновь образующейся кристаллической фазами. Коэффициент кристаллизации D в системе H2S - Rn равен 2 3; следовательно, радон концентрируется в кристаллах. Различие в значениях коэффициента кристаллизации элементов нулевой группы по отношению к различным носителям ( гексагидратам различных газов) дает возможность проводить разделение благородных газов химическим путем. [30]
Страницы: 1 2 3