Расчет - константа - диссоциация
Cтраница 2
В отчете должен быть описан метод потенциометриче-ского титрования, приведены таблица результатов, график, расчеты константы диссоциации и исходной концентрации кислоты. [16]
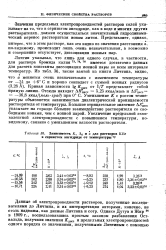 |
Зависимость К, Л0 и а для растворов КВг в сернистом ангидриде от температуры 7Р. [17] |
Личтин указывал, что лишь для одного случая, в частности, для раствора бромида калия 73 7 76 имеется достаточно данных для расчета константы диссоциации ионной пары во всем интервале температур. [18]
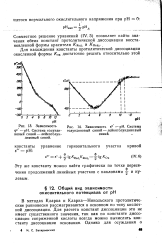 |
Зависимость рис 14. Зависимость е - рН. Система. [19] |
В методах Кларка и Кларка-Никольского протолитиче-ские равновесия рассматриваются в основном по типу кислотной диссоциации. Для расчета констант диссоциации это не имеет существенного значения, так как по константе диссоциации сопряженной кислоты всегда можно вычислить константу диссоциации основания. [20]
Из рисунка видно, что кривые титрования всех продуктов, кроме III ( см. табл.) имеют один перегиб, соответствующий нейтрализации одной в мопо - и обеих групп - ОН в диоксидифенилсульфонах. Кривая титрования продукта III характеризуется двумя заметными скачками. Для расчета констант диссоциации были использованы значения рН до начала скачка, так как эта область обеспечивает наиболее точные данные. [21]
Кривая нейтрализации кислоты ( рисунок) хорошо совпадает с кривой, приведенной в литературе [6], что подтверждает чистоту взятой кислоты. Кривая имеет отчетливо выраженные буферные области, соответствующие диссоциации протонов карбокси-групп и первого фенольного гидроксила. Однако для расчета констант диссоциации фенольных групп необходимо более точное измерение рН в щелочной области, что пока не представляется возможным. [22]
Если / Сд / С, то при определении К кислоту можно считать одноосновной и пользоваться методами, применимыми к одноосновным кислотам. В этом случае для расчета констант диссоциации используются числа переноса, на основании которых определяются количества перенесенных ионов с различными зарядами. Подобным методом было найдено, что первая ступень диссоциации серной кислоты завершается полностью даже при больших концентрациях. Этому значению константы при концентрации кислоты с 0 1 соответствует а. Таким образом, rbSC является довольно сильной кислотой и на второй ступени диссоциации, однако концентрация SO - все же зависит от концентрации кислоты. [23]
Если К - / С, то при определении К кислоту можно считать одноосновной и пользоваться методами, применимыми к одноосновным кислотам. В этом случае для расчета констант диссоциации используются числа переноса, на основании которых определяются количества перенесенных ионов с различными зарядами. Подобным методом было найдено, что первая ступень диссоциации серной кислоты завершается полностью даже при больших концентрациях. Таким образом, H2SO4 является довольно сильной кислотой и на второй ступени диссоциации, однако, концентрация SO все же зависит от концентрации кислоты. [24]
Концентрационная зависимость электрической проводимости слабых электролитов имеет более сложный характер ( см. рис. 8.2, кривая 2), чем у сильных электролитов. Это объясняется тем, что на электрическую проводимость слабых электролитов влияют не только электрофоретический и релаксационный эффекты, как это наблюдается у сильных электролитов, но и увеличение степени диссоциации электролита с разбавлением раствора, вызывающее в области разбавленных растворов более быстрое, чем у сильных электролитов, увеличение электрической проводимости. Данные по электрической проводимости растворов слабых электролитов часто используются для расчета констант диссоциации. [25]
Количественные характеристики растворов даются на основе классической теории электролитической диссоциации. В связи с этим для сильных электролитов ( к ним относятся все растворенные в природных водах соли) при расчете констант диссоциации, равновесия, гидролиза и др. используют активности или умножают аналитически определяемые концентрации ионов на соответствующие коэффициенты активности. Согласно эмпирической теории Льюиса и Рендалла при концентрациях электролитов т 0 02 моль / л, что близко к солевому составу пресных вод, средний коэффициент активности диссоциирующего на ионы вещества у является функцией ионной силы раствора ( я, которая суммарно оценивает влияние силовых полей ионов на различные свойства растворов. [26]
Применение титриметрического метода с введением сильной кислоты в качестве фона вместо нейтрального электролита обладает тем преимуществом, что при этом строго стандартизированы условия проведения эксперимента во всех его сериях. Применяют различные приемы расчета экспериментальных результатов рН - метрических измерений. Исходными моментами этих расчетов является знание начальных концентраций каждого из исследуемых компонентов системы, нахождение констант кислотности или основности лиганда и составление уравнений, описывающих условия материального баланса и электронейтральности. Для решения систем таких уравнений предложены разнообразные алгебраические и графические преобразования, позволяющие рассчитать, осно-в ываясь на ряде допущений, соответствующие константы устойчивости комплексов аналогично тому, как это показано на примере расчетов константы диссоциации кислот, по Шварцер-баху. В других случаях используют прием введения вспомогательных функций, легко рассчитываемых из экспериментальных данных и связанных простыми зависимостями искомыми константами. [27]
Страницы: 1 2