Расчет - константа - равновесие - реакция
Cтраница 1
Расчеты констант равновесия реакций по ( III, 71) с использованием значений / из ( 111, 76) и ( 111, 77) дают менее точные результаты. [1]
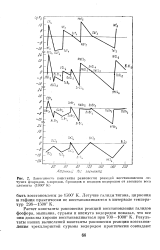 |
Зависимость константы равновесия реакций восстановления летучих фторидов, хлоридов, бромидов и иодидов водородом от атомного веса - элемента ( 1000 К. [2] |
Расчет константы равновесия реакций восстановления галидов фосфора, мышьяка, сурьмы и висмута водородом показал, что все они должны хорошо восстанавливаться при 700 - 1000 К. [3]
Расчет констант равновесия реакций ионизации инертных газов в настоящем Справочнике не проводился, поскольку атомы инертных газов имеют высокие потенциалы ионизации. [4]
Для расчета констант равновесия реакции ( 9) важное значение имеет выбор теплоты образования магнетита ( Рез04), поскольку данная величина определяет точность всего расчета. К сожалению, несмотря на большое количество работ, посвященных определению теплоты образования Рез04, провести однозначный выбор наиболее надежного значения ДЯобр ( Рез04) в настоящее время затруднительно. [5]
Для расчета константы равновесия реакции 2Вг С125 Вг2 2СГ пользуются значениями нормальных потенциалов хлорного и бромного электродов. Для удобства расчетов оба значения потенциала берутся для одинакового, в данном случае газообразного состояния. [6]
Для расчета константы равновесия реакции 2Вг С12 Вг2 2СГ пользуются значениями нормальных потенциалов хлорного и бромного электродов. Для удобства расчетов оба значения потенциала берутся для одинакового, в данном случае газообразного состояния. [7]
 |
Определение степени превращения пропилена aCjH ( i в реакции С3Н6 НС1.. С3НТС1 при известном значении Ig Kp ( графический метод. [8] |
Выше при проведении расчетов константы равновесия реакции предполагалось, что газообразные реагенты подчиняются зависимостям, справедливым для идеальных газов, и значение КР при постоянной температуре не зависит от давления. [9]
Ниже приведены результаты расчетов константы равновесия реакции восстановления окиси хрома алюминием в интервале температур 1500 - 3000 К. [10]
Им также предложен способ расчета констант равновесия реакций по методу однотипных реакций. Однотипными реакциями названы такие две реакции, в которых каждому компоненту одной соответствует однотипный или одинаковый с ним компонент другой. Лучшие результаты применительно к органическим соединениям метод однотипных реакций дает для расчета констант равновесия аналогичных реакций гомологов, если в результате реакции наблюдается одинаковое изменение числа молей. [11]
Это уравнение может быть использовано для расчета констант равновесия реакций, проводимых в газовой фазе. [12]
Уравнения (3.20.27) и (3.20.28) лежат в основе расчета констант равновесия реакций по их стандартным мольным энергиям Гиббса и наоборот. Способ расчета Ад по термодинамическим таблицам изложен ранее ( см. разд. Здесь же мы еще раз напомним, что в большинстве таблиц за стандартные состояния чистых жидких и кристаллических веществ приняты их реальные состояния, а за стандартные состояния чистых газов - их состояния в виде чистых идеальных газов при давлении 1 атм. Поэтому расчет приводит к величинам Кг для реакций в конденсированных растворах и к К X X ( [ р ] 1 атм) для реакций в газовых растворах. [13]
Выражение ( 181) весьма удобно для расчета констант равновесия реакций, протекающих в паре, тая как при его использовании не требуется устанавливать значение той или иной производной. [14]
Уравнения (3.20.27) и (3.20.28) лежат в основе расчета констант равновесия реакций по их стандартным мольным энергиям Гиббса и наоборот. Способ расчета AgvT по термодинамическим таблицам изложен ранее ( см. разд. Здесь же мы еще раз напомним, что в большинстве таблиц за стандартные состояния чистых жидких и кристаллических веществ приняты их реальные состояния, а за стандартные состояния чистых газов - их состояния в виде чистых идеальных газов при давлении 1 атм. Поэтому расчет приводит к величинам Кг для реакций в конденсированных растворах и к К X X ( [ р ] 1 атм) для реакций в газовых растворах. [15]
Страницы: 1 2