Расчет - равновесная концентрация
Cтраница 1
Расчеты равновесных концентраций в растворах слабых оснований несколько отличаются от тех, что мы уже рассматривали. Пиридин и бензоат-ион в воде относятся к таким слабым основаниям по Бренстеду - Лоури. [1]
Расчеты равновесных концентраций по реакциям 5 и 6 дают величины выходов, значительно меньшие, чем наблюдаемые на опыте. Это связано, по-видимому, с тем, что скорости разложения N0 при температурах, развивающихся при взрывах смесей закиси азота с озоном относительно бедных озоном ( 0 - 40 об. % Оз), невелики. [2]
Расчет равновесных концентраций по уравнениям изотерм равновесия представляет сложную задачу, так как расчету подлежат шесть неизвестных. Беленькая и Резников [2] предложили графический метод расчета концентраций ионов Си21 и Zn2 в растворах, обменная адсорбция из которых приводит к получению определенных их соотношений на Ка - пермутите. [3]
Расчет равновесных концентраций из условия минимизации энергии Гиббса может быть использован при анализе физических и химических равновесий в тех случаях, когда определение равновесных составов представляет собой самостоятельную задачу. При моделировании экстракционных процессов расчет равновесных характеристик должен быть подчинен общей алгоритмической стратегии, учитывающей также кинетику межфазного переноса и структуру потоков в аппарате. [4]
Расчет равновесной концентрации по уравнению (7.2) может быть выполнен подбором. [5]
Расчет равновесной концентрации углеводородов по методу Де-Пристера для термодинамических условий холодного потока показал, что при достигнутой температуре не должна была происходить конденсация компонентов. [6]
Расчет равновесной концентрации трехокиси азота значительно осложняется, так как наряду с образованием N2O3 из окиси и двуокиси происходит также образование N2O4 из двуокиси азота. [7]
Расчет равновесных концентраций моноядерных частиц по исходным аналитическим концентрациям не вызывает никаких трудностей, если известны константы образования всех сосуществующих равновесий. [8]
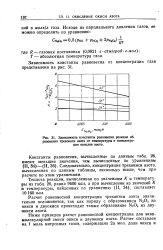 |
Зависимость константы равновесия реакции образования трехокиси азота от температуры и концентрации окислов азота. [9] |
Расчет равновесной концентрации трехокиси азота значительно осложняется, так как наряду с образованием N2O3 из окиси и двуокиси происходит также образование N2O4 из двуокиси азота. [10]
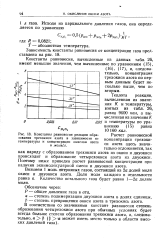 |
Константы равновесия реакции образования трехокиси азота в зависимости от температуры и концентрации окислов азота в моль. л. [11] |
Расчет равновесной концентрации трехокиси азота здесь значительно осложняется, так как наряду с образованием трехокиси азота из окиси и двуокиси происходит и образование четырехокиси азота из двуокиси. Поэтому ниже приведен расчет равновесной концентрации при наличии эквимолекулярной смеси и двуокиси азота. [12]
Расчет равновесной концентрации закиси железа в сварочной ванне при раскислении ее углеродом показывает, что повышение содержания углерода в ванне снижает содержание FeO в наплавленном металле. [13]
Расчет равновесных концентраций различных частиц в системе показал, что доли гидролизированных ионов металлов для всех изученных систем очень малы, а дополнительной диссоциации при комплексообра-зовании практически не происходит, поэтому два последних слагаемых в уравнении ( 1) близки к нулю. Решение уравнения ( 1) произведено на ЭЦВМ Наире-2 методом наименьших квадратов. Погрешности в величинах ДЯ оценены по методу Васильева и Козловского [8, 12] с учетом погрешностей в константах устойчивости комплексов, погрешностей в определении концентраций ионов металлов и щелочи, а также точности калориметра. [14]
Для расчета равновесных концентраций задаются несколькими значениями температур в интервале кипения НКК и ВКК. [15]
Страницы: 1 2 3 4