Значение - коэффициент - разделение
Cтраница 2
В табл. V-24 приведены значения коэффициентов разделения разбавленных растворов примесей в четыреххлористом германии. Органические примеси, содержащиеся в техническом четыреххлористом германии, более летучи, чем основа. К наиболее трудноотделяемым из них относятся 1 2-дихлор-этан ( а. Как неорганические, так и органические примеси могут быть удалены из технического четыреххлористого германия методом ректификации. Однако для достижения глубокой очистки процесс должен проводиться в аппаратах с высокой разделяющей способностью, так как относительная летучесть некоторых примесей имеет величину близкую к единице. [16]
Сравнение с приводившимися выше значениями коэффициентов разделения Н / Т для ртути и галлия ( 3 - 11; 3 - 16; 4 2; 14) показывает, что этот вывод из модели Хориучи-Поляни полностью расходится с экспериментом. [17]
На этом же рисунке приведены значения коэффициента разделения самих газовых смесей. [19]
Как видно из таблицы, значения коэффициентов разделения во всех системах, за исключением смеси метилтрихлорсн-лан - треххлористый фосфор, в области микроконцентраций хлоридов фосфора и железа достаточно велики, что говорит о потенциальной возможности очистки данных продуктов от указанных мнкропримесей обычной ректификацией. [20]
 |
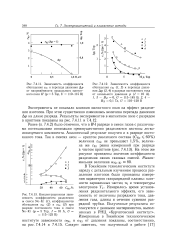
Коэффициент разделения ( а и разделительная мощность ( б при различных способах возбуждения цир . [21] |
Для примера на рис. 4.16 приведены значения коэффициента разделения q и разделительной мощности 6U, вычисленные приведенным выше методом. Гидродинамика этой центрифуги была исследована в § 4.2 для следующих четырех способов возбуждения циркуляции. [22]
В табл. V-5 представлены найденные экспериментально значения коэффициентов разделения при атмосферном давлении. Разбавленные растворы 1 1-дихлорэтана и 1 2-дихлорпропана в хлороформе и хлороформа и трихлорэтилена в четыреххлористом углероде близки к идеальным. В остальных случаях отклонения а от аип довольно значительны и расчет ректификации в предположении идеальности раствора может привести к существенным ошибкам. [23]
Это видно из приведенных на рис. 2.7 значений коэффициентов разделения. Анализ данных по ионному обмену показывает на принципиальную возможность получения цеолитсодержащих систем с различным соотношением катион-ных и декатионированных участков и проверки влияния этого соотношения на активность в различных реакциях. [24]
Распределение примесей по секциям происходит в соответствии со значениями коэффициентов разделения 2 системы рафинируемый металл - примесь. В процессе электролиза электроположительные примеси практически не принимают участие в электродной реакции и накапливаются в амальгамном аноде, а более электроотрицательные металлы-примеси совместно с рафинируемым металлом растворяются и переходят в электролит. На амальгамном катоде из электролита разряжаются практически только ионы рафинируемого металла, а перешедшие в электролит более электроотрицательные примеси остаются практически полностью в электролите. [25]
Сопоставлены экспериментальные и теоретические ( рассчитанные по квантовомеханической теории) значения коэффициентов разделения. Они с точностью 14 - 18 % согласуются с опытными данными. [26]
 |
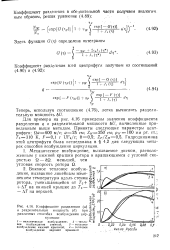
Коэффициент разделения изотопных разновидностей ряда низкокипящих веществ. [27] |
На рис. 5, взятом из работы [150], сопоставлены значения коэффициента разделения а Рц / Pi изотопных разновидностей низкокипящих двухатомных веществ ( кроме водорода) в зависимости от температуры. Как видно из рисунка, у окисей азота изотопные эффекты в давлении пара исключительно большие несмотря на то, что они по сравнению с другими данными относятся к значительно большим температурам. [28]
В системе Оа ( СН3) з - H - C7Hi6 значение коэффициента разделения в области малых концентраций н - С7Н16 достаточно велико ( а - 3 7) для эффективного удаления примеси н-гептана из триметилгаллия. Большее, по сравнению с идеальным, значение коэффициента разделения ( а 3 7) для раствора триметилгаллия в н-гептане позволяет более полно выделять триметилгаллий в колонне-реакторе. [29]
Доводы Гориучи и его утверждение, что ни одного из двух значений коэффициентов разделения изотопов водорода Н и D, отвечающим двум различным группам металлов ( около 3 для ртути и около 7 для никеля), нельзя получить на основании теории замедленного разряда, не были опровергнуты. [30]
Страницы: 1 2 3 4