Расчет - молекула - водород
Cтраница 1
Квантово-мехакический расчет молекулы водорода показал, что для взаимодействия атомов ( и молекул) из всех известных в природе сил имеют значение только электрические силы. При этом существенную роль играют упомянутые выше квантовые свойства электронов, без учета которых невозможно понимание природы химической связи и химических свойств атомов и молекул. [1]
 |
Длины и энергии связей для Н2 и Н2. [2] |
При расчете молекулы водорода Колос и Рутан ( 1960 г.) использовали волновую функцию, содержащую 50 членов. Такие вычисления стали осуществимы только благодаря появлению быстродействующих электронных вычислительных машин. [3]
Квантово-механический подход к расчету молекулы водорода сходен с тем, который только что был приведен для случая молекулярного иона водорода. [4]
Метод, использованный для расчета молекулы водорода, явился обоснованием метода валентных связей. [5]
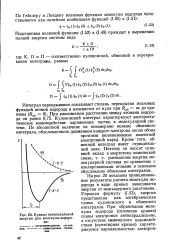 |
Кривые потенциальной КУЛЫ водорода ( сплошная кривая энергии для молекулы водоро - спины электронов антипараллельны, да. а отсутствие химического взаимодей. [6] |
На рис. 20 показаны принципиальные результаты расчета молекулы водорода в виде кривых зависимости энергии от межъядерного расстояния. [7]
В 1933 г. Джеймс и Кулидж провели расчет молекулы водорода, не выражая двухэлектронную функцию У через атомные орбйтали сра и ф &, а непосредственно включив в нее величину г 2 и используя сфероидальные координаты. [8]
В 1933 г. Джеймс и Кулидж провели расчет молекулы водорода, не выражая двухэлектронную функцию Ч через атомные орбитали р и ф а непосредственно включив в нее величину г12 и используя сфероидальные координаты. [9]
 |
Взаимодействие электронов с ядрами в молекуле водорода Н2. [10] |
Гейзенбергом для расчета атома гелия, к расчету молекулы водорода, показали, что го-меополярная связь в молекуле водорода обусловлена обменным взаимодействием электронов, сконцентрированных преимущественно между двумя ядрами. Природа химических связей получила таким образом физическое или, точнее, квантово-механическое обоснование. [11]
 |
Взаимодействие электрических зарядов. [12] |
Лондон и Гайтлер в 1927 г. впервые произвели расчет молекулы водорода. [13]
В 1957 г. Джой и Парр [64,82,65] выполнили расчет молекулы водорода ( с одноцен-тровой волновой функцией) с дробными численными значениями эффективных главных квантовых чисел. Полученные ими результаты, а позже и другими исследователями, показывают, что варьирование полной энергии рассчитываемой системы по квантовым числам приводит к существенному понижению энергии по сравнению со значением энергии, вычисленным при целых значениях квантовых чисел. [14]
 |
Образование МО системы А - В ( ра, ( р из орбиталей фрагментов А и В ( qa. [15] |
Страницы: 1 2