Расчет - молекула - водород
Cтраница 2
Решение уравнения (9.9), очевидно, идентично задаче расчета МО молекулы водорода ( см. разд. [16]
Метод валентных связей ( ВС) возник непосредственно на базе расчета молекулы водорода, выполненного Гайтлером и Лондоном ( разд. Основная физическая идея метода ВС базируется на том представлении, что химическая связь образуется в результате спаривания спинов двух электронов, находящихся на однократно занятых валентных орби-талях соответствующих атомов молекулы; основная цель метода ВС состоит в построении соответствующих электронных молекулярных волновых функций, для которых возможные химические связи описываются как результат спаривания отдельных пар электронов. Эту процедуру построения многоэлектронной волновой функции в методе ВС мы уже сопоставляли ( разд. МО, основная задача которого - добиться представления волновой функции одним детерминантом, в котором молекулярные орбитали, каким-либо образом делокализованные по всей молекуле, являются линейными комбинациями рассматриваемых базисных атомных орбиталей АО. Метод ВС как метод построения достаточно хороших молекулярных электронных волновых функций сильно дискредитировали за последние двадцать лет, и теперь его обычно рассматривают просто как некоторую полуэмпирическую схему, в которой многие величины считаются эмпирическими параметрами. Вместе с тем следует подчеркнуть, что на основе метода ВС можно развить математически совершенно строгую теорию, которую с успехом можно использовать для проведения неэмпирических расчетов. Метод ВС заслуживает большего внимания, чем обычно ему уделяют. [17]
Следует отметить, что только что описанный метод является весьма удачным методом расчета молекулы водорода. В общем случае более сложных молекул можно исходить из представления о двух ядрах, больших, чем протон, и строить оболочки для этого случая, как это уже было сделано при решении задачи с одним ядром. Возбужденные состояния молекулы являются состояниями, в которых один или несколько электронов находятся не на низших возможных орбитах. Если, например, в молекуле водорода один из электронов находится в состоянии, рассмотренном в связи с молекулярным ионом водорода, и характеризуется функцией фд - ЬФв, а второй находится в состоянии, выражаемом функцией фА - фв, что, как было показано в § 10.4, соответствует более высокой энергии, то молекула водорода будет находиться в возбужденном состоянии. Однако точное соответствие между возбужденным состоянием, получаемым таким путем, и состоянием, рассмотренным в § 10.3, не может быть установлено. Это обусловлено тем, что оба пути описания молекулы основаны на разных приближенных допущениях и вследствие этого точное совпадение оказывается невозможным. Практически метод, описанный в этом параграфе, дает, повидимому, больше неустойчивых состояний при исходных волновых функциях фА и фв, чем метод § 10.3, так как можно полагать, что функция фд фв переходит в функцию ls - состояния гелия, если ядра совмещены, а функция ФА - фв переходит в функцию одного из 2р - состояний гелия. Если имеются два электрона с противоположными спинами в ФА фв - состоянии, то получается 1 s2 - или основное состояние гелия. [18]
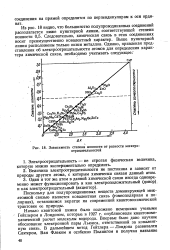 |
Зависимость степени ионности от разности электро-отрйцательностей. [19] |
Начало квантовой химии было положено немецкими учеными Гейтлером и Лондоном, которые в 1927 г. опубликовали квантовоме-ханический расчет молекулы водорода. Впервые было дано научное обоснование электронной пары Льюиса, ответственной за ковалент-ную связь. [20]
Первый метод ( метод валентных связей), берущий свое начало в работе Гейтлера - Лондона по расчету молекулы водорода, Хюкке-лем применяется в той форме, которую придал ему Блох при разработке теории ферромагнетизма. [21]
Обсуждение ковалентиого связывания в молекулах всех типов почти всегда основано на применении пробных волновых функций одного из двух видов, которые возникли в ранних работах при расчете молекул водорода. [22]
Обсуждение ковалентного связывания в молекулах всех типов почти всегда основано на применении пробных волновых функций одного из двух видов, которые возникли в ранних работах при расчете молекул водорода. [23]
Этим расчетом был качественно выяснен квантово-механический смысл валентного штриха - основного символа языка химических структурных формул. Из расчета молекулы водорода, выполненного Гейтлером и Лондоном, следовало, что валентный штрих имеет смысл пары электронов с антипараллельными спинами. Волновая функция этой электронной пары обеспечивает в - пространстве между двумя атомными ядрами локализацию отрицательного заряда электронов, достаточную для удержа-ния обоих ядер на таком расстоянии, при котором имеет смысл рассматривать всю систему, образованную двумя атомами, как единую молекулу. [24]
В качестве одноэлектронных волновых функций, описывающих состояние электрона в кристалле, могут быть выбраны волновые функции электрона в отдельном изолированном атоме ( узле) решетки. В этом случае разным состояниям nt электрона соответствуют атомные функции разных узлов кристалла. Такой выбор одноэлектронных функций тем более оправдан, чем меньше взаимодействие между атомами кристалла. Для расчета молекулы водорода такой метод был впервые применен Гайтлером и Лондоном ( II. Следует отметить, что атомные волновые функции разных узлов решетки не ортогональны друг к другу, поэтому их нельзя интерпретировать как решения уравнений Хартри - Фока. В некоторых случаях пренебрегают неортогональностью ( перекрытием) атомных волновых функций разных узлов или же подвергают исходные атомные функции процессу ортогонализации. [25]
Только для молекулы водорода ( содержащей два ядра и два электрона) и молекулярного иона водорода ( содержащего два ядра и один электрон) волновая функция может быть рассчитана непосредственно и точно решением волнового уравнения Шредингера. Для всех других молекул употребляются приближенные методы. Для органических и особенно ароматических молекул приняты два метода расчета. Первый опирается на способ, использованный Гейтлером - Лондоном при расчете молекулы водорода. В нем энергия системы из двух ядер и двух электронов вычисляется как функция расстояния между ядрами. Разность Е0 - Е, определяющая прочность связи, называется энергией резонанса или энергией резонансной стабилизации. Этот метод ( АО - атомных орбит или валентных связей) применим главным образом для дву-электронной или ковалентной связи и имеет большое значение в органической химии. [26]
Остановимся на квантовой химии, которая бесспорно опирается на фундаментальные положения квантовой механики. Теорема Борна - Оппенгеймера выводится в рамках строгой квантовой механики, она устанавливает возможность раздельного описания атомных ядер и электронов молекулы. Историю квантовой химии обычно ведут от расчетов молекулы водорода, выполненных В. [27]
Страницы: 1 2