Расчет - молекулярный орбиталь
Cтраница 1
 |
Строение некоторых соединений непереходных элементов. [1] |
Расчеты молекулярных орбиталей показывают, что энергия орбитали существенно зависит от степени перекрывания и от степени смешивания s - и р-орбиталей. Таким путем Уолш ( 1953) получил ряд важных выводов относительно форм молекул, подтвержденных экспериментальными данными. [2]
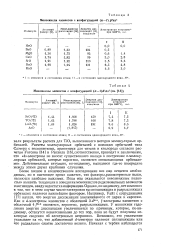 |
Моноокислы элементов с конфигурацией ( п - / p6 / zs2.| Моноокислы элементов с конфигурацией ( - 1 Р - Я82 (. [3] |
Расчеты молекулярных орбиталей с помощью орбиталей типа Слэтера с экспонентами, принятыми для титана и кислорода согласно расчетам Уотсона [ 141 и Ранзила [16] соответственно, приводят к заключению, что ч4з - электроны не вносят существенного вклада в построение а-молеку-лярных орбиталей, которые вероятно, являются связывающими орбиталя-ми. Действительная ситуация, по-видимому, находится где-то посередине между этими двумя крайними случаями. [4]
 |
Виды гибридизации связей. [5] |
Для расчетов молекулярных орбиталей чаще всего применяют метод ли. [6]
Применение выражения (14.3) для расчета молекулярных орбиталей требует итерационной процедуры. Сначала необходимо предположить определенное значение q, и рассчитать уточненное значение аг. Цикл повторяется до получения постоянного результата. Метод Уэланда-Манна поэтому принадлежит к расчетам типа самосогласованного поля ( см. разд. [7]
Применение выражения (14.3) для расчета молекулярных орбиталей требует итерационной процедуры. Сначала необходимо предположить определенное значение дг и рассчитать уточненное значение аг. Цикл повторяется до получения постоянного результата. Метод Уэланда-Манна поэтому принадлежит к расчетам типа самосогласованного поля ( см. разд. [8]
Гораздо сложнее применить результаты, полученные при расчетах молекулярных орбиталей, к сверхтонкому расщеплению от взаимодействия с атомами, отличными от атома водорода. В отличие от протонов, для которых характерны только описанные выше прямой и косвенный механизмы СТВ, на сверхтонкое расщепление от взаимодействия с 13С влияют и другие факторы: 1) Неспаренные электроны на р ( л) - орбитали могут поляризовать заполненные 25 - и ls - орбитали того же самого атома. Может иметь место прямая делокализация электронной плотности на 25-орбиталь а-радикала. Спиновая плотность на соседнем атоме углерода за счет поляризации а-связи С - С может вызывать появление спиновой плотности на 2s - и 2р - орбиталях углерода, резонанс которого поддается интерпретации. [9]
Для плоских молекул, ненасыщенных и ароматических, было проведено множество расчетов молекулярных орбиталей с рассмотрением по отдельности а - и я-электронов. [10]
В то время как спектры поглощения [256], измерения диамагнитной анизотропии [261] и расчеты молекулярных орбиталей [262] позволяют предполагать некоторый ароматический характер боразина и его производных, химические свойства соединений нельзя считать типичными для ароматических соединений. Систематическое изучение химии боразинов свидетельствует о таком поведении циклов, как будто свободные электронные пары локализованы у атома азота, а группы-заместители при атомах бора и азота несут суммарный отрицательный и положительный заряд соответственно. [11]
Читатель должен иметь в виду, что остов молекулы, образованный сигма-связями, считается жестким и расчет молекулярных орбиталей выполняется только для пи-орбиталей. [12]
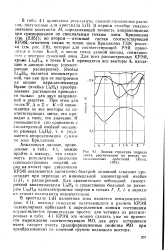 |
Зонная структура гидрида лития, рассчитанная по методу локализованных орбиталей ( Кунц, 1975. [13] |
В кристалле LiH валентная зона является невырожденной ( рис. 4.1), поэтому отнесение получающихся в расчете КРЭЯ молекулярных орбиталей к определенным зонным состояниям осуществляется сравнительно просто: для четырех из рассмотренных в табл. 4.1 КРЭЯ это можно сделать уже по кратности вырождения соответствующих МО, для двух оставшихся ячеек следует учесть трансформационные свойства МО при преобразованиях из точечной группы волнового вектора. [14]
При решении задач методом молекулярных орбиталей предполагается, что при образовании химической связи сначала сближаются только ядра и лишь затем на образующихся многоцентровых молекулярных орбиталях размещаются валентные электроны, причем при расчете молекулярных орбиталей используется тот же подход, что и при расчете атомных орбиталей. [15]
Страницы: 1 2