Значение - коэффициент - активность
Cтраница 1
 |
Значения коэффициента активности ионов f. [1] |
Значение коэффициента активности при известной ионной силе может быть взято из справочника. В табл. 12 приведены значения коэффициента активности при температуре 25 С. [2]
Значения коэффициента активности понижаются с повышением ионной силы раствора и с повышением валентности иона. [3]
 |
Значения констант закона Рауля для некоторых веществ. [4] |
Значение коэффициента активности зависит от температуры, природы раствора и его концентрации. [5]
Значения коэффициентов активности обычно получают по данным о равновесии пар-жидкость или исходя из какой-либо модели жидкости, как это рассмотрено в гл. Для межфазной поверхности никакие непосредственные измерения невозможны, поэтому должна быть принята модель жидкости. Гильдебрант и Скотт [26] трактуют случай идеальной межфазной поверхности ( т - l), B то время как Эккерт и Праусниц [13], а также Спроу и Праусниц [55] используют теорию регулярных растворов для описания фазы. Во всех случаях А аппроксимируется как ( Vj) 2 3 ( Л) 1 / / 3, где Vt - мольный объем чистого компонента i, а N0 - - число Авогардо. Спроу и Праусниц успешно применили уравнение (12.5.4) к ряду различных неполярных бинарных смесей и точно рассчитали поверхностное натяжение ат. Даже для полярных смесей был Достигнут некоторый успех, хотя в этом случае для межфазной поверхности использовалось модифицированное выражение Вильсона для коэффициентов активности и одна эмпирическая константа была сохранена, чтобы достигалось лучшее соответствие рассчитанных значений от экспериментальным данным. [6]
Значение коэффициентов активности, вычисленное по уравнению (5.1.47), может дать лучшее согласие с экспериментом, если численное значение а принимать не постоянным, а несколько изменяющимся для различных диапазонов концентраций. Некоторое непостоянство а обусловлено не только тем ( как считали ранее), что степень гидратации также может изменяться при изменении концентрации, но также и тем, что гидратированные ионы не являются в действительности жесткими шарами и могут быть деформированы или проникать друг в друга в зависимости от условий столкновения, изменяющего минимальное расстояние между ионами. [7]
Значения коэффициентов активности в бинарном ( у э) и тройном ( уэ) растворах определены относительно единого стандартного состояния - гипотетического раствора со свойствами бесконечно разбавленного в сухом растворителе. [8]
 |
Значения коэффициента i Вант-Гоффа для некоторых растворов. [9] |
Значения коэффициента активности позволяют судить о природе раствора. Зная, например, что коэффициент активности для 1 0 Мл раствора Lil 0 910, а для 1 0 Мл раствора Csl он равен 0 533, можно сделать вывод, что в растворе Lil ионы намного более независимы друг от друга, чем в растворе Csl такой же концентрации. [10]
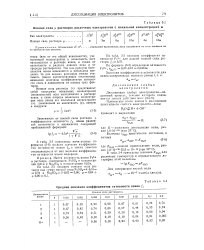 |
Ионная сила ц растворов различных электролитов с моляльной концентрацией м. [11] |
Значения коэффициентов активности для недиссоциированных молекул равны. [12]
Значения коэффициентов активности хорошо согласуются с данными статических измерений, что свидетельствует о достаточной надежности хроматографических данных. В то же время при оценке неидеальности растворов в хроматографи-ческой колонке необходимо учитывать неидеальность газовой фазы. Целесообразность введения поправок на неидеальность определяется необходимой точностью получаемых результатов. При больших перепадах давления или при использовании тяжелых газов-носителей ошибка, естественно, возрастает, так как в этом случае заметно увеличивается взаимодействие газа с сорба-том, приводящее к изменению суммарного коэффициента активности. [13]
Значение коэффициентов активности понижается с возрастанием ионной силы раствора, зависящей от концентрации и зарядов всех присутствующих в растворе ионов. [14]
 |
Коэффициенты активности ( f одно -, двух - а трехзарядных ионов при различной ионной силе раствора. [15] |
Страницы: 1 2 3 4