Расчет - равновесие - реакция
Cтраница 2
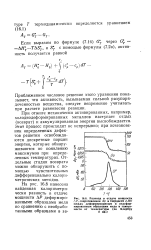 |
Разница в отдаче мощности ДР, сопротивлении Др и твердости ДЯУ между деформированным и недеформированным образцами меди в зависимости от температуры ( по Клербру и др. [16] |
Приближенное числовое решение этого уравнения показывает, что активность, вызываемая сильной разупоря-доченностью вещества, следует непременно учитывать при расчете равновесия реакции. [17]
Данные табл. V-2 могут использоваться либо для непосредственного определения при любых температурах значений IgK и AZ процессов расплавления веществ, либо для расчетов равновесия реакций взаимодействия жидких металлов с другими веществами. [18]
Значения высокотемпературных составляющих энтальпии [ Н ( Т) - - Я ( 298) ] и функции ф - - ( Г) - н ( 298) для большинства веществ приводятся в справочниках. Расчет равновесия реакций с помощью приведенных термодинамических потенциалов Ф и Ф широко используется на практике. [19]
Указанная точка зрения вызывает серьезные опасения. Проделанные ОРГРЭС расчеты равновесия реакции окисления VaO4 показали, что при господствующих в топке температурах и избытках кислорода четырех-окись ванадия почти полностью переходит в VaOs. Даже если ванадий и не окисляется, это не меняет существа дела, так как не он один вызывает процесс шлакования. В пользу высказанного опасения говорит и интенсивное шлакование котлов, сжигающих малосернистые мазуты, в составе которых практически ванадия нет. [20]
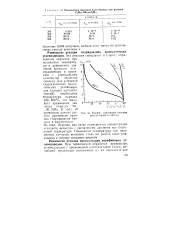 |
Равновесная массовая доля бензола при реакции.| График равновесия реакции ароматизации н-гептана. [21] |
В табл. 10 приведены данные расчета равновесия реакции гидрирования бензола в циклогексан. [22]
Следует сделать ряд замечаний о выборе исходных термодинамических величин. Данные, приводимые в таблицах главы II и использованные нами при расчетах равновесий реакций, рассматриваемых в этой главе, являются более точными по сравнению с данными, использованными Кольбелем и Энгельгардтом. [23]
Эти уравнения могут быть использованы в качестве поправок на фазовые превращения для расчета равновесия реакций, в которых участвует железо при температурах выше температур превращений. [24]
В тех случаях, когда необходимо вычислить среднечисловую молекулярную массу или конверсии различных функциональных групп, последние могут быть определены из решения соответствующих уравнений, выражающих закон действующих масс для этих групп. Существенно, что такой метод не требует вычисления РСР макромолекул и в этом смысле аналогичен расчету равновесия реакций между низкомолекулярными реагентами. [25]
Термодинамическим методом может быть рассчитана не только максимальная полнота окисления редоксита, но и глубина превращения редокс-пары в растворе, контактирующем с редокситом, и, в частности, глубина обескислороживания раствора. Максимально возможная исходная и равновесной концентрации следует, что медьсодержащий редоксит способен полностью обескислороживать воду. К аналогичному результату приводит расчет равновесия реакции взаимодействия кислорода с гидро-хинонным, висмутовым и другими редокситами, обладающими восстановительными свойствами. [26]
Полученные данные об окислении ниобия, растворенного в железе, показывают, что этот элемент практически полностью переходит из металла в окислительный шлак. Установленная количественная зависимость показателя распределения ниобия от температуры относится к случаю, когда активность закиси железа в шлаке равна единице. Это позволяет подойти к расчету равновесия реакции окисления ниобия в случае реальных шлаков и оценить возможные потери ниобия при введении его лигатуры. [27]
Функции М и N, относящиеся к каждой данной модификации марганца, могут быть непосредственно использованы для составления уравнения логарифма константы равновесия реакции взаимодействия марганца с другими веществами или для перехода марганца из одной модификации в другую. Случай взаимодействия разбирается в следующем примере, а пока покажем, как используются функции М и N для составления уравнений lg / С и AZ переходов. В связи с аддитивностью IgK и AZ такие уравнения могут быть полезны как поправочные в расчетах равновесия реакций, в которых марганец участвует при температурах выше температур превращений. [28]
Необходимо обратить внимание на то, что при равновесии скорости прямой и обратной реакций равны между собой. Однако при термодинамическом расчете равновесия ( при выводе закона действующих масс) не требуется детально знать механизм реакции, определяющий ее скорость. Достаточно иметь итоговое стехиоме-трическое соотношение для реакции типа ( 4 - 3), определяющее только баланс масс участвующих в реакции веществ. В частности, соотношение ( 4 - 4) применимо для расчета равновесия реакций ( 4 - 1), ( 4 - 2) и других аналогичных реакций, хотя механизм этих реакций очень сложен. Реакции горения водорода и окиси углерода протекают через ряд промежуточных стадий по цепному механизму. Как будет видно из дальнейшего, детали этого механизма крайне существенны при вычислении скоростей реакций. Однако эти детали не играют роли при расчете равновесия. [29]
В связи с отсутствием в справочной - литературе термодинамических характеристик для жидких металлов разработанная автором ранее вспомогательная таблица к приближенному и точному расчетам равновесия почти не содержит функций М, N и Аср для жидких веществ. Однако, как это было показано в предыдущем параграфе, эти трудности могут быть преодолены современными теоретико-расчетными методами термодинамики. N и Дср, необходимых для приближенного и точного расчетов равновесия реакций, в которых участвуют жидкие металлы. Функции эти были определены почти для всех металлов. Сводка этих функций представлена в табл. V-2. Последняя может служить дополнением к ранее составленной вспомогательной таблице [18, 40] и позволит, не делая никаких дополнительных пересчетов или поправок, сразу производить расчеты равновесия реакций с участием жид - ких веществ. [30]
Страницы: 1 2 3