Расчет - равновесное состояние
Cтраница 1
Расчет равновесных состояний очень трудоемок, особенно при большом количестве равновесных компонентов, поэтому несомненный интерес представило бы издание таблиц равновесных составов, определенных в достаточно широком диапазоне исходных составов, температур и давлений. Авторами статьи был произведен термодинамический расчет на ЭВМ БЭСМ-ЗМ составов равновесных гомогенных смесей и их полных энтальпий при температуре реагирования ( / р) и при 293 15 К ( / эз) - Было рассчитано 61 исходное соотношение между С, Н и О при давлениях 0 1; 1 и 10 атм в интервале температур 1000 - 4000 К с учетом 40 равновесных компонентов. [1]
Расчеты равновесных состояний нефтяных смесей наиболее часты в технологии переработки нефти и газа ( см. разд. [2]
При расчете первого равновесного состояния, которое приобретает тело под действием внешнего поля, будем полагать среду изотропной в обычном смысле ( конечно, при достаточных априорно имеющихся для этого основаниях) и для расчета распределения J воспользуемся уравнением (2.252) или методами гл. Вектор Т ( М) при этом первом после размагниченного равновесном состоянии определяет предысторию намагничения в каждой точке тела, направление его совпадает с направлением Ъq локальной оси анизотропии, которое необходимо использовать для расчета следующего равновесного состояния. [3]
Основная задача расчета равновесного состояния системы ( и координат реакций) может быть рассмотрена следующим образом. [4]
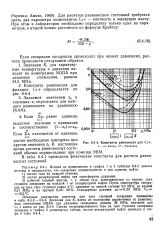 |
Константы равновесия для С.. [5] |
В настоящее время расчеты равновесных состояний обычно осуществляют при помощи ЭВМ. [6]
Практическое применение термодинамических уравнений для расчета фазовых химических равновесных состояний смесей и растворов реальных веществ связано со сложностью определения их летучестей и активностей - введенных Льюисом понятий, заменяющих концентрации веществ, и вытекающих из этих понятий коэффициентов летучести и активности. [7]
Практическое применение термодинамических уравнений для расчета фазовых, химических равновесных состояний смесей реальных веществ связано со сложностью определения введенных Льюисом ( 1901 г.) понятий летучести и активности веществ и вытекающих из этих понятий, коэффициентов летучестей и активностей, которые позволили сохранить простоту термодинамических уравнений, полученных на основе, гиперболической модели идеального газа, но перенесли основную трудность на определение этих коэффициентов. [8]
Почему аппарат сопротивления материалов неприемлем при расчете равновесного состояния бруса некруглого поперечного сечения при кручении. [9]
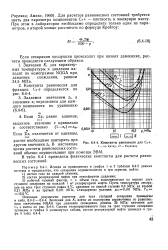 |
Константы равновесия для С.. [10] |
В табл. 6.4 - 1 приведены физические константы для расчета равновесных состояний. [11]
Сопоставление значений Е по таблице для различных редокссистем в равновесии при равных концентрациях может быть использовано для расчетов равновесных состояний. Так, например, константа равновесия обратимой гидрогенизации и дегидрогенизации легко может быть получена из значений потенциалов участвующих веществ. [12]
Расчеты равновесного состояния существенно зависят от того, содержит ли система избыток горючего или окислителя. При значительном избытке горючего имеющееся количество кислорода недостаточно для превращения всего горючего в газообразные компоненты, сгорание сопровождается образованием сажи, равновесные продукты реакции оказываются гетерогенными. [13]
Проведено качественное исследование фазовых переходов типа газ - жидкость в бинарных смесях вблизи критических точек. Для расчета равновесных состояний использован метод минимизации термодинамического потенциала. С помощью теории катастроф установлены некоторые общие закономерности для критичег: ого поведения смесей. Сформулированы условия существования областей ретроградных явлений. [14]
Данное уравнение применимо только для паровой фазы. При расчете равновесных состояний жидкость - пар в условиях высокого давления это уравнение используют для представления паровой фазы. В целях описания жидкой фазы его употребляют в сочетании с вариантом уравнения, в состав которого введен параметр растворимости. Данная методика, очевидно, является значительно более эффективной по сравнению с другими, гораздо более сложными методами исследования. Для смесей разработаны и применены на практике правила усреднения, составлены также уравнения для расчета величин фугитивности и изменений энтальпии. Однако, чтобы данная методика могла соперничать с методами, основанными на уравнении Бенедикта - Уэбба - Рубина - Старлинга и уравнении Ли - Кесле ра, необходимы дополнительные испытания. [15]
Страницы: 1 2