Расчет - энтальпие
Cтраница 2
Измерение и расчет энтальпий смешения в бинарных и тройных системах полярные растворители - ароматические углеводороды. [16]
Данные для расчета энтальпий ниже 298 15 К часто не являются надежными, поэтому в настоящей книге в качестве стандартной температуры для энтальпии принята температура 298 К. [17]
Для удобства расчетов энтальпия влажного воздуха также относится к 1 кг сухого воздуха. [18]
В [25] приведен расчет средних энтальпий связи C-Hal ( HalF, C1, Вг) и сделан вывод, что хлориды и бромиды термически неустойчивы и при повышении температуры легко разлагаются на исходные компоненты. [19]
 |
Два способа расчета энтальпии. [20] |
Несмотря на возможность расчета энтальпий по уравнению ( 1 - 38), наиболее точным методом ее определения является все же непосредственное экспериментальное измерение. [21]
Заканчивая рассмотрение способов расчета энтальпий разбавления ассоциированных электролитов, отметим, что помимо общего подхода возможны в отдельных случаях и частные варианты. Например, при измерении энтальпий ионизации калориметрическим путем при различных концентрациях растворов возможно определение и последующее использование в расчете АЯразб величин, представляющих собой сумму изменения АЯИониз и ЛЯсх ( или АЯнедис. Принципы расчета при этом остаются неизменными. [22]
Было установлено, что расчет энтальпий этим способом не имеет существенного преимущества. [23]
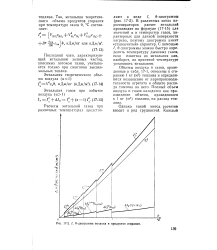 |
I, Ф - диаграмма воздуха и продуктов сгорания. [24] |
В различных зонах парогенераторов расчет энтальпий производят по формуле ( 17 - 15) для значений а и температур газов, характерных для данной поверхности нагрева, поэтому диаграмма имеет ступенчатый характер. С помощью /, Ф - диаграммы можно быстро определить температуру дымовых газов, если известна их энтальпия или, наоборот, по принятой температуре установить энтальпию. [25]
Распространение модели ASOG на расчеты избыточных энтальпий состоит в следующем. [26]
Подобным же путем производят расчет энтальпий образования перекисей. [27]
Механизм галогенирования алканов подтверждается расчетом энтальпий каждой стадии принятого механизма и альтернативного пути реакции ( R - Н - С1 - v RC1 - Н; - Н С12 - НС. [28]
Вследствие этого наиболее целесообразным представляется расчет условных энтальпий образования ионов в различных для каждого растворителя, но аналогично построенных шкалах. Естественно, в случае необходимости эти величины могут быть легко выражены н в других шкалах. [29]
Представляется важным подчеркнуть, что такой расчет энтальпий разбавления возможен лишь для сильных электролитов при наличии безусловной уверенности в полной диссоциации электролита в растворе и в отсутствии в нем каких бы то ни было комплексов или ассо-циатов. Само по себе наличие линейной зависимости ДЯразб от - fm такой уверенности не дает, поскольку подобная линейная зависимость наблюдается, например, для слабых электролитов с малой величиной константы диссоциации. [30]
Страницы: 1 2 3 4