Расчет - энтальпии - образование
Cтраница 2
Очевидно, уравнение типа (II.2) может быть использовано для расчета энтальпии образования любого участника процесса ( II. [16]
Для некоторых классов веществ в рамках метода групповых вкладов разработана параметризация для расчета энтальпии образования в твердой фазе, показана возможность применения метода. [17]
Например, О2М ( КСС) - расчет занижает энергию атомизации перок-сида водорода всего на 0.4 кДж / моль [122], что соответствует такой же погрешности при расчете энтальпии образования. [18]
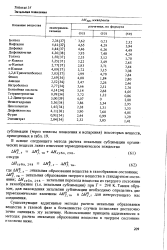 |
Энтальпия плавления. [19] |
Существующие аддитивные методы расчета энтальпии образования вещества в газовой фазе в большинстве случаев позволяют достаточно точно оценивать эту величину. Использование принципа аддитивности в методах расчета энтальпии образования вещества в твердом состоянии изложено ниже. [20]
Данные расчета энтальпии сублимации гексадекановой и октаде-кановой кислот расходятся с экспериментальными величинами на - - 5 ккал / моль. Такие же расхождения получены при расчете энтальпии образования этих кислот в газовой фазе, поэтому указанные соединения нуждаются в дополнительных экспериментальных исследованиях. [21]
Данные расчета энтальпии сублимации гексадекановой и октаде-кановой кислот расходятся с экспериментальными величинами на - 5 ккал / моль. Такие же расхождения получены при расчете энтальпии образования этих кислот в газовой фазе, поэтому указанные соединения нуждаются в дополнительных экспериментальных исследованиях. [22]
В настоящее время имеются данные по кинетике термического распада некоторых полинитросоединений. Как и для нитропроизводных метана, результаты этих исследований в сочетании с термохимическими данными можно использовать при расчете энтальпии образования нитроалифати-ческих радикалов и энергий диссоциации связей. [23]
Данные Конна, Кистяковского, Робертса и Смита [258] и Вадсо [1558] хорошо согласуются в отношении энтальпии гидролиза жидкого уксусного ангидрида до жидкой уксусной кислоты, для которых энтальпия равна соответственно - 13 96 и - 14 00 ккал / молъ. Среднее значение - 13 98 ккал / молъ использовано наряду с энтальпиями образования уксусной кислоты и воды для расчета энтальпии образования уксусного ангидрида АЯ / 98 ( Z) 149 14 ккал / молъ. [24]
Данные Копна, Кистяковского, Робертса и Смита [ 2581 и Вадсо [1558] хорошо согласуются в отношении энтальпии гидролиза жидкого уксусного ангидрида до жидкой уксусной кислоты, для которых энтальпия равна соответственно - 13 96 и - 14 00 ккал / молъ. Среднее значение - 13 98 ккал / молъ использовано наряду с энтальпиями образования уксусной кислоты и воды для расчета энтальпии образования уксусного ангидрида ДЯ / 9Ч ( I) 149 14 ккал / молъ. [25]
Скотт и Мак-Каллох [1316] рассчитали термодинамические свойства путем прибавления удвоенного метиленового инкремента к соответствующим значениям для этилпропилсульфида. Инкременты, рекомендованные Персоном и Пиментелом [1140], использовали для расчета термодинамических функций, а инкременты Прозена, Джонсона и Россини [1196] - для расчета энтальпии образования ( g) - 34 85 ккал / моль. [26]
Скотт и Мак-Каллох [1316] рассчитали термодинамические свойства путем прибавления удвоенного метиленового инкремента к соответствующим значениям для этилпропилсульфида. Инкременты, рекомендованные Персоном и Пиментелом [1140], использовали для расчета термодинамических функций, а инкременты Прозена, Джонсона и Россини [1196] - для расчета энтальпии образования АЯ / 298 ( g) - 34 85 ккал / моль. [27]
Величина Г ( NO2 - С - С), равная 3 4ккал / моль ( 6 8 на 2 взаимодействия), полученная из этого соединения, точно совпадает со значением, выведенным из анализа экспериментальных данных по моно -, ди - и тринитрометильным соединениям. Такое совпадение косвенно подтверждает правильность экспериментальных термохимических данных по пентанитропропану, гексанитроэтану и кинетических измерений энергии диссоциации С-N - связей в гек-санитроэтане, необходимых при расчете энтальпии образования пентанитроэтильного радикала. [28]
Схема с образованием перхлората титанила оказывается несколько более предпочтительной, так как устойчивость хлоридных комплексов титанила невелика, а концентрация перхлората в растворе оказывается на несколько порядков больше концентрации хлорида. Это, однако, не может явиться решающим доводом, так как все участники данной реакции в растворе диссоциированы почти нацело. Расчет энтальпии образования растворов по уравнениям типа (IV.66) не требует сведений о химизме процесса растворения и вместе с тем полученные на основании таких уравнений результаты представляют значительный интерес и существенно обогащают термохимию. Это не означает, конечно, что состав соединений, образующихся в растворе, не представляет интереса для термохимии. Эти вопросы вызывают большой интерес, однако возможности расчета в основном определяются не калориметрическими данными а надежностью констант равновесия, без которых вообще невозможна однозначная интерпретация многих термохимических данных, например расчет энтальпий реакций ступенчатого комплексообразования в растворе. Особое значение в термохимии растворов имеет вопрос о стандартных энтальпиях образования отдельных ионов ( см. гл. [29]
Энтальпия образования окситрифторида азота, рассчитанная по энергиям диссоциации связей, равна - 33 ккал / моль. Эта величина заведомо неверна. Однако в работе [410] она используется для расчетов энтальпии образования F2NO BFJ. Тогда для А Я / я ( F2NOBF4) находится значение, равное 323 ккал / моль. [30]
Страницы: 1 2 3