Термодинамический расчет - реакция
Cтраница 1
Термодинамический расчет реакций ( I) показывает, что в интервале температур 100 - 200 С они практически необратимы. [1]
Вышеприведенные термодинамические расчеты реакций в системе Са ( ОН) 2 - SiO2 - H2O выполнены только для начального и конечного состояния системы, но не учитывают механизма процесса. [2]
Термодинамические расчеты реакций разложения показывают, что лнфатические связи С-С разрываются ранее связей С - Н, а ароматические связи значительно прочнее алифатических. [3]
Термодинамические расчеты реакций образования интерметалли-дов и фазовый анализ покрытий показали, что при насыщения этих металлов в расплаве чистого или легированного одним или несколькими элементами алюминия возможно возникновение в поверхностном слое сложной многофазной структуры. [4]
Термодинамические расчеты реакций взаимодействия полиморфных металлов при температурах, превышающих температуру перехода, требуют связанных с модификацион-ными превращениями поправок к величинам энтальпий, энтропии, констант равновесия и изобарных потенциалов. Учет этих поправок необходим даже в случае использования приближенных методов расчета. [5]
Проведен термодинамический расчет реакций образования этилбензола и изомеров диэтилбензола, н-пропилбензола и изопропилбензола в интервале температур 298 16 - 1000 К. [6]
Выполнен термодинамический расчет реакции алкилирования карбоновых кислот С2 - С4 н-бутенами для случая протекания процесса в жидкой фазе. Проведено экспериментальное сравнение активности указанных кислот в реакции алкилирования их н-бутенами в жидкой фазе на ионитном формованном катализаторе КИФ-2. Показано, что наиболее активна в данной реакции уксусная кислота. [7]
Результаты термодинамического расчета реакции (6.7) показывают, что при пониженном давлении она заканчивается при температуре ниже 1800 С. Такой расчет фактически является очень большим упрощением, поскольку в системе ( оксиды урана) - ( углерод) протекает множество промежуточных химических реакций, приводящих ( см. рисунки 6.2 - 6.4) к образованию низших оксидов урана, карбидов, оксикарбидов, твердых и жидких растворов. [8]
При термодинамических расчетах реакций ДЯ, AZ и Д5 определяют простым алгебраическим суммированием, при этом погрешности также суммируются. Величина суммарной ошибки зависит и от стехиометрии реакции. [9]
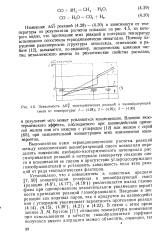 |
Зависимость AGj. экзотермических реакций в пепообразующей смеси от температуры. 1 -. 2 -. 3 . [10] |
Выполненные нами термодинамические расчеты реакций между компонентами пепообразующей смеси позволили определить изменение изобарно-изотермического потенциала рассматриваемых реакций в интервале температур спекания смеси и вспенивания ее спеков в присутствии углеродсодержащю газообразователейи установить зависимость хода этих реак ций от ряда технологических факторов. [11]
Предварительно был проведен термодинамический расчет реакции для идеальной системы при атмосферном давлении. Результаты рас-счета, приведенные в табл. 1, показывают, что понижение температуры реакции сдвигает равновесие в сторону образования этилацетата, аналогичное влияние оказывает и увеличение мольного соотношения этилен: уксусная кислота. [12]
Предварительно представлялось интересным провести термодинамический расчет реакции дегидратации кротилового спирта. Для кротилового спирта отсутствуют данные о свободной энергии, теплосодержании, энтропии, изменении теплоемкости от температуры. [13]
Кинни и Боннер [23] провели термодинамический расчет реакции С6Н6 - - СО, СвН5СООН и пришли к выводу, что результаты предыдущей работы [22] были ошибочными. [14]
Они предназначены для быстрого проведения термодинамических расчетов реакций углеводородов и их производных. [15]
Страницы: 1 2 3