Термодинамический расчет - реакция
Cтраница 2
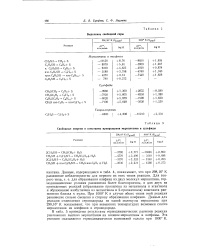 |
Свободные энергии и константы превращения меркаптанов в сульфиды. [16] |
В табл. 5 приведены результаты термодинамических расчетов реакции разложения высших меркаптанов на низшие меркаптаны и олефины. Эта реакция оказывается термодинамически возможной только при 1000 К. [17]
Проведенный анализ литературных данных показывает, что термодинамический расчет реакций алкилирования бензола не является достаточно полным. В связи с этим был проведен термодинамический анализ некоторых реакций алкилирования бензола этиленом в газовой фазе с целью определения оптимальных условий для получения максимально возможных выходов продуктов, образующихся при осуществлении процесса в присутствии гетерогенного катализатора. [18]
В литературе мало имеется работ, посвященных термодинамическим расчетам реакций гидрогенолиза сераорганических соединений. [19]
Для определения условий анализа серы в элементарном селене произведены термодинамические расчеты реакций восстановления серы до сероводорода. [20]
Результаты рассмотрения доступных литературных данных говорят о том, что для осуществления полных термодинамических расчетов реакций в системе Са ( ОН) 2 - SiO2 - H2O в нормальных и гидротермальных условиях необходимо определить основные термические константы ( Cp f ( T), A / / 29g, AZ298, 529S) почти для всех гидросиликатов кальция, а также для силикатных и полисиликатных ионов в водном растворе. [21]
Изменяются его энтропия, энтальпия, свободная энергия, что должно быть учтено в термодинамических расчетах реакций с участием растворов. [22]
Ранее нами был предложен метод прогнозирования вторичного загрязнения воздушной среды промышленно развитых городов и регионов методом программированного термодинамического расчета вероятных реакций превращения первичных загрязнителей во вторичные. [23]
В монографии на современном научном уровне изложены практические и теоретические основы алкилирования бензола пропиленом и ароматических углеводородов другими реагентами, приведен термодинамический расчет реакции алкилирования, с кваитово-химических позиций рассмотрено строение молекулы бензола, строение активных центров ( полиэдров) в алюмосиликатах и цеолитах, сформулирован новый механизм взаимодействия активных центров и молекул реагирующих веществ. Обоснованы новые взгляды на кинетику реакции алкнлирования и составлены кинетические уравнения для процессов, проходящих в статической, полупроточной и проточной системах, в гомогенных и гетерогенных условиях. Представлены экспериментальные зависимости влияния температуры, давления, времени контакта, мольного соотношения реагентов, ультрафиолетового и Y - излучений и других факторов на выход продуктов алкилирования. Обсуждены вопросы промотирования катализаторов. Монография может быть использована в практической и научной деятельности инженерами и научными работниками предприятий химической, нефтехимической и нефтеперерабатывающей промышленности, научными работниками академических институтов, отраслевых НИИ и КБ, может служить также учебным пособием для преподавателей, аспирантов и студентов вузов химико-технологических специальностей. [24]
Высказанные в работе [7] положения о характере диссоциации некоторых тугоплавких окислов при температурах ниже температуры кипения металла окисла МеО послужили основанием для проведения термодинамического расчета реакций взаимодействия в системах МегС - МеО, МеЮ - МеО при температурах ниже температуры кипения металла окисла МеО по двум схемам. Кип) металлическая фаза является конденсированной фазой и в расчете не учитывается. [25]
В работе приведены результаты изучения реакций алкилирования уксусной кислоты этиленом в паровой фазе в присутствии кислых катализаторов. Термодинамический расчет реакций показал, что для увеличения выхода этнлацетата необходимо уменьшить температуру проведения реакции и увеличивать мольное соотношение этилен: уксусная кислота. Изучение влияния ряда факторов на реакцию позволило выбрать условия, в которых конверсия уксусной кислоты составляет 65 % при 100 % - ной селективности. [26]
На основании термодинамических расчетов можно полагать, что при силицировании молибденовой проволоки, нагреваемой электросопротивлением, в окружающей ее газовой смеси в наибольшем количестве содержится силан HSiCl3, так как температура газовой смеси в этом случае всегда ниже температуры проволоки. Термодинамический расчет реакции ( 61) показал, что она возможна при температуре 850 К и выше. [27]
В отличие от обессеривания при помощи пиролюзита, описанного в патентной литературе [3], пиролюзит и другие марганцевые руды применяются нами в атмосфере водорода, что создает благоприятные практические условия для образования сероводорода из сераорганических соединений и дальнейшего его перехода в сульфид марганца. Термодинамические расчеты реакций гидрогенолиза сераорганических соединений типа содержащихся в нефтях показывают, что их равновесие сдвинуто в сторону образования сероводорода и соответствующего углеводорода, однако практически глубина гидрогенолиза не для всех сераорганических соединений является достаточно полной. Ее можно резко увеличить, если в процессе гидрогенолиза катализатором-адсорбентом из газовой фазы будет удаляться сероводород. Это и достигается применением восстановленного пиролюзита или восстановленной марганцевой массы, полученной на базе гидрата закиси марганца и карбоната марганца. [28]
Уменьшение количества водяных паров, содержащихся в исходной смеси, также приводит к снижению степени превращения этилена в спирт, но одновременно повышается концентрация спирта в получаемом спиртоводяном конденсате, что имеет существенное значение при промышленном осуществлении реакции прямой гидратации. Аналогичные закономерности наблюдаются при термодинамическом расчете реакции присоединения воды к пропилену при получении изопропилового спирта. [29]
В 1931 г. Кинни и Ланглуа [101] сообщили о том, что им удалось получить небольшое количество бензойной кислоты ( 0 13 % от веса исходного бензола) при нагревании бензола и углекислоты в течение 10 час. Однако четыре года спустя Кинни и Боннер [102] провели термодинамический расчет реакции С6Н6 С02 С6Н6СООН и пришли к выводу, что результаты предыдущей работы [101] были ошибочными. [30]
Страницы: 1 2 3