Стехиометрический расчет
Cтраница 2
По стехиометрическому расчету на 1000 кг 92 % - ного каустика расходуется 1283 кг 95 % - ной кальцинированной соды; однако из-за потерь в производстве расход Na2C03 колеблется в пределах 1350 - 1400 кг. [16]
По стехиометрическому расчету па одну молекулу рицино-левой кислоты требуется одна молекула серной кислоты. Практически же всегда серную кислоту берут с большим избытком. [17]
В стехиометрических расчетах для окислительно-восстановительных процессов используют окислительный и восстановитель ный эквиваленты. Это частное от деления относительной молекулярной массы на число приобретаемых ( теряемых) электронов. Так, в рассмотренной выше реакции окисления H2S перманганатом калия в кислой среде для КМпО4 окислительный эквивалент равен 158 / 5, а для сероводорода восстановительный эквивалент - половине его молекулярной массы. [18]
В стехиометрических расчетах для окислительно-восстановительных процессов используют окислительный и восстановительный эквиваленты. Это частное от деления относительной молекулярной массы на число приобретаемых ( теряемых) электронов. Так, в рассмотренной выше реакции окисления H2S перманганатом калия в кислой среде для КМпО4 окислительный эквивалент равен 158 / 5, а для сероводорода восстановительный эквивалент - половине его молекулярной массы. [19]
При стехиометрических расчетах реакций, в которых участвуют полимерные вещества, молем ( основным молем) условно называют молекулярный вес элементарного звена. [20]
На основании стехиометрических расчетов, из 1116 5 г ( 7 159 5) сернокислой меди получается 806 5 г основной соли меди приведенного состава. В этом количестве основной соли содержится 444 5 г ( 7 - 63 5) меди. [21]
После проведения стехиометрических расчетов составляют таблицу материального баланса. Чаще всего расчеты относятся к 1000 или 100 кг продукта или сырья. [22]
При проведении стехиометрических расчетов окислительно-восстановительных реакций органических соединений удобно пользоваться формальным представлением о степени окисления атомов. Под степенью окисления атома подразумевают заряд, которым обладал бы атом, если бы все его ковалентные связи с атомами других элементов превратились бы в ионные. Направление смещения электронной пары ковалентнои связи определяется на основании сопоставления электроотрицательности атомов, участвующих в ее образовании. [23]
Во многих стехиометрических расчетах приходится использовать данные по составу растворов. [24]
Во всех стехиометрических расчетах, относящихся к процессам горения, имеет место сохранение числа атомов каждого химического элемента, участвующего в данном процессе. Именно с помощью этого закона устанавливаются стехиометрические коэффициенты в химическом уравнении. [25]
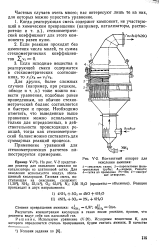 |
Контактный аппарат для окисления аммиака. [26] |
Применение уравнений для стехиометрических расчетов иллюстрируется примерами. [27]
Поэтому для удобства стехиометрических расчетов сгорания топлива введено понятие приведенного углерода, обозначаемого Kv. Здесь сера, содержащаяся в топливе, заменяется эквивалентным по потребности кислорода для сгорания количеством углеоода. [28]
Она служит основой для всевозможных стехиометрических расчетов по химическим формулам и уравнениям, вычисления молекулярных масс химических соединений. [29]
Обычно серу добавляют по стехиометрическому расчету для перевода всего сульфита в тиосульфат. Процесс проходит при температуре около 150 - - 160 С. Добавка 0 003 % селена ( от массы раствора) позволяет проводить реакцию при температуре 135 С. По этому способу получают ценные вторичные продукты - элементарную серу и сульфат аммония, но при этом расходуется значительное количество аммиака и пара. [30]
Страницы: 1 2 3 4