Электростатический расчет
Cтраница 2
Отталкивание серы и притяжение кислородов, рассчитанные согласно более старым теориям, имеют меньшую величину, чем в теории Косякова и Харкера. Если разности отталкивательных сил и сил притяжения взаимно погашаются, то простой электростатический расчет должен дать правильные результаты, даже в том случае, если в прежних теориях есть доля истины; электростатическая теория действительно дает, как мы увидим, превосходные результаты. [16]
Так как каждый ион стремится притянуть к себе возможно больше противоположно заряженных, структура ацидо-комплекса должна была бы соответствовать максимально допустимому по объемным соотношениям координационному числу. Однако в действительности оно часто не достигается вследствие взаимного отталкивания аддендов, тем более сильного, чем больше их накапливается в внутренней сфере. Как показал электростатический расчет, отвечающее наибольшей энергии комплексообразования координационное число зависит от зарядов и комплексообразователя, и аддендов. Из рис. XIV-56 виден характер этой зависимости для однозарядных аддендов при различных валентностях комплексообразователя. Оказывается, например, что у четырехвалентных центральных атомов наиболее устойчивым должно быть координационное число шесть. При повышении заряда аддендов их взаимное отталкивание возрастает сильнее, чем притяжение к центральному атому. Поэтому отвечающие определенным его валентностям наиболее устойчивые координационные числа соответственно уменьшаются, как это видно на рис. XIV-57. Несмотря на то что в целях упрощения расчета радиусы центральных ионов и аддендов принимались за равные и не учитывались другие их свойства ( структура электронных оболочек, поляризуемость), результаты этих упрощенных расчетов довольно хорошо согласуются с экспериментально определенными координационными числами большинства комплексообразователей. Общий вывод, который может быть сделан из приведенных результатов, заключается в том, что повышению координационного числа благоприятствует увеличение заряда центрального иона и уменьшение заряда аддендов. [17]
Так как каждый ион стремится притянуть к себе возможно больше противоположно заряженных, структура ацидо-комплекса должна была бы соответствовать максимально допустимому по объемным соотношениям координационному числу. Однако в действительности оно часто не достигается вследствие взаимного отталкивания аддендов, тем более сильного, чем больше их накапливается в внутренней сфере. Как показал электростатический расчет, отвечающее наибольшей энергии комп-лексообразования координационное число зависит от зарядов и комплексообразователя, и аддендов. [18]
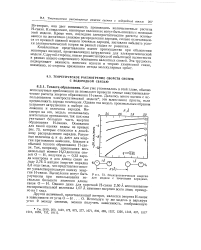 |
Электростатическая энергия-для модели с точечными зарядами. [19] |
Во-вторых, она дает возможность производить количественные расчеты Н - связи. К сожалению, некоторые явления не могут быть описаны с помощью-этой модели. Кроме того, последние электростатические расчеты основываются на достаточно сложном распределении зарядов, сильно отличающемся от прежней наивной модели точечных зарядов, заставляя забывать успехи электростатической теории на ранней стадии ее развития. [20]
Количество теплоты, необходимое для переноса моля электролита из кристаллической фазы в разбавленную газовую фазу, весьма велико, например для бромистого натрия при 25 С оно составляет 177 ккал / моль. Однако, с одной стороны, теплота растворения этой кристаллической соли в воде равна нулю, так что взаимодействие ионов с растворителем должно быть сильно экзотермическим. С другой стороны, грубые электростатические расчеты показывают, что поле, которое действует ча ближайших соседей иона, в растворе должно быть весьма велико, порядка 106 - 107 В / см В зависимости от принятого значения диэлектрической проницаемости энергия электростатического взаимодействия молекулы воды с ионом натрия в непосредственной близости от нее составляет около 0 3 - 0 5 ккал / моль, тогда как RT 0 6 ккал / моль при комнатной температуре. Эти соображения, а также громадное количество различных экспериментальных фактов привели к теории сольватации ионов, т.е. рассмотрению более или менее специфичного взаимодействия некоторого иона с одной или несколькими молекулами растворителя. [21]
В отличие от легко определяемых опытным путем кинетических свойств, таких, например, как ионная проводимость, термодинамические свойства отдельных ионов невозможно определить, поскольку для этого нельзя предложить соответствующий чисто термодинамический эксперимент. Именно поэтому термодинамические функции иона Н в стандартном состоянии условно принимают за нуль. С другой стороны, большинство теорий сольватации ионов основано на электростатических расчетах, которые можно выполнить лишь для отдельных ионов. [22]
Страницы: 1 2