Рауль
Cтраница 3
Закон Рауля применим к смесям химически подобных компонентов, которые не взаимодействуют друг с другом. Для смесей сложных углеводородов отклонения от закона Рауля зависят от того, подобны ли компоненты или нет. [31]
Закон Рауля приложим к расчетам процессов перегонки. [32]
Закон Рауля в том виде, как он нами только что высказан, приложим однако далеко не во всех случаях. Большинство смесей, с которыми приходится иметь дело на практике, отклоняется от закона Рауля. [33]
 |
Атомная теплота сублимации твердых металлов при 18 С, ккал. [34] |
Законы Рауля и Генри в общем случае описывают поведение любых бесконечно разбавленных растворов. [35]
Законы Рауля будут справедливы по-прежнему только для разбавленных растворов. [36]
Закон Рауля позволяет непосредственно вычислить действительный молекулярный вес растворенного вещества на основании данных, характеризующих давление насыщенного пара растворителя над раствором. [37]
 |
Прибор для определения степени диссоциации электролита криоскопическим методом. [38] |
Законы Рауля и Вант-Гоффа [ см. уравнения (8.3), (8.4) и (8.19) ] справедливы только для разбавленных растворов неэлектролитов. Растворы электролитов обнаруживают значительные отклонения от этих законов вследствие электролитической диссоциации. Как было показано, это дает возможность опытным путем определять поправочный коэффициент i и по нему рассчитывать степень диссоциации электролита. [39]
Закон Рауля позволяет непосредственно вычислить действительную молекулярную массу растворенного вещества на основании данных, характеризующих давление насыщенного пара растворителя над раствором. [40]
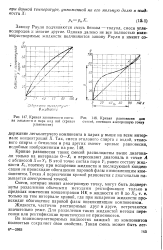 |
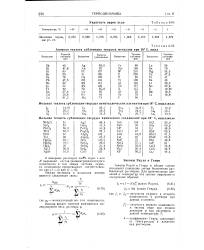
Кривая зависимости соста - [ IMAGE ] 148. Кривая равновесия для ва жидкости и пара над ней ( кривая смесей, имеющих азеотропную точку равновесия. [41] |
Закону Рауля подчиняются смесь бензол - толуол, смеси углеводородов и многие другие. [42]
Закон Рауля выглядит достаточно простым, но с молекулярной точки зрения он часто вызывал недоумения: можно ли допустить, что относительное понижение упругости пара зависит только от мольной доли, но не от природы второг компонента, когда размеры молекул обоих компонентов сильно отличаются. [43]
Закон Рауля применим до сравнительно очень высоких концентраций, как это видно из примера табл. 48 для растворов скипидара в эфире ( Рауль, 1888), однако при больших содержа ниях скипидара отклонения от закона Рауля заметны. [44]
Формула Рауля выражает закономерность, согласно которой в разбавленных растворах условия существования молекул растворителя практически остаются теми же, что и в чистом растворителе, так как только при этом давление пара растворителя может быть пропорциональным его мольной доле в растворе. [45]
Страницы: 1 2 3 4