Электролитическое рафинирование - металл
Cтраница 1
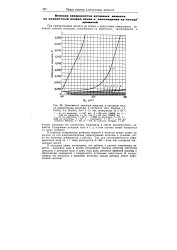
Теоретически электролитическое рафинирование металлов, в частности меди, при бесконечно малых плотностях тока и обратимых значениях потенциалов должно проходить без затраты энергии, так как анодный потенциал равен катодному, остальные же слагаемые при бесконечно малых плотностях тока равны нулю. [1]
При электролитическом рафинировании металлов, например меди, толстые пластинки сырой ( неочищенной) меди подвешиваются в электролитической ванне, наполненной раствором соли меди ( например, CuSO4), и соединяются с анодом источника тока. Катодом служат тонкие пластинки из чистой меди, покрытые графитом. В процессе электролиза анодные пластинки из сырой меди будут все время растворяться, а катодные - наращиваться чистой медью. Слой графита на катодных пластинках служит для снятия наращенной меди. [2]
В процессе электролитического рафинирования металла растворяется черновой анод. При этом поляризация обусловливается возрастанием концентрации ионов металла в прианод - HQM пространстве. Примеси, входящие в черновой анод, могут образовывать самостоятельные фазы. При этом потенциал анода определяется наиболее электроотрицательным компонентом смеси, более положительные компоненты не растворяются. [3]
Нередки случаи, когда растворы электролитического рафинирования металлов загрязняются тонкими взвесями анодного шлама. При электролизе с нерастворимым анодом в растворе могут образовываться высокодиоперсные взвеси мельчайших частиц двуокиси свинца, графита различных размеров, от молекулярных до микронных. [4]
Пассивность анода вредна в случае электролитического рафинирования металлов и в большинстве случаев применения для гальванотехники, когда работают с растворимым анодом. [5]
Анодный шлам, получающийся при электролитическом рафинировании металла Доре в виде порошка, содержит от 30 - 70 % серебра и значительное количество золота. [6]
Растворимые аноды, применяемые при электролитическом рафинировании металлов, - это многокомпонентные сплавы, представляющие собой эвтектическую смесь, твердый раствор либо химические соединения. Сплав с эвтектикой составляют двухфазную систему, в которой каждый из компонентов образует отдельную фазу. [7]
Как отмечалось выше, чистый кобальт производят электролитическим рафинированием металла, полученного термическим восстановлением оксида кобальта, который содержит значительные примеси никеля, железа и других металлов. Благодаря высокой катодной поляризации при выделении кобальта становится возможным включение в катодный осадок не только меди, но и никеля, и железа. Поэтому для получения1 чистого кобальта4 требуется весьма тщательная очистка ряетвора от этих примесей, особенно от никеля. [8]
Как отмечалось выше, чистый кобальт производят электролитическим рафинированием металла, полученного термическим восстановлением оксида кобальта, который содержит значительные примеси никеля, железа и других металлов. Благодаря высокой катодной поляризации при выделении кобальта становится возможным включение в катодный осадок не только меди, но и-никеля, и железа. Поэтому для получения чистого кобальт требуется весьма тщательная очистка раствора от этих примесей, особенно от никеля. [9]
В главах III - VIII яри описании процессов электролитического рафинирования металлов или их электролитического получения из растворов приведены данные о силах тока, применяемых на отдельных установках. Сила тока в цепи колеблется в зависимости от масштабов производства от 2000 до 25000 а. Ее подбирают из расчета получения стандартного напряжения в электрической цепи последовательно включенных ванн. [10]
Наряду с производством первичных металлов все большее распространение находят электролитическое рафинирование металлов с целью получения конечного продукта повышенной чистоты и получение сплавов электролизом. [11]
Многократно описывалось применение растворов тетрафторо-боратов как электролита для гальваностегии и электролитического рафинирования металлов: свинца [161, 247], цинка [248], кадмия [249], олова [250], родия [251], никеля [252], меди [253] и др. Как правило, электролиты этого типа обладают высокими электропроводностью, коэффициентом диффузии и рассеивающей способностью и позволяют работать с высокой плотностью тока. [12]
Второе направление электролиза водных растворов с получением металлов заключается в электролитическом рафинировании металлов. В этом случае подлежащий рафинированию так называемый черновой металл используется в качестве анода, а на катоде осаждается чистый металл. При электролитическом рафинировании чернового металла в качестве побочных продуктов получают находящиеся в нем драгоценные металлы: золото, серебро и металлы платиновой группы. [13]
Процессы электролиза водных растворов в металлургии подразделяются на две группы: электролитическое рафинирование металлов и электроэкстракция. [14]
Страницы: 1 2