Рацемаз
Cтраница 2
Частично очищенная ферментная фракция, полученная из клеток этого микроорганизма, превращает каждый из изомеров метионина в рацемат; реакция активируется при добавлении пиридоксальфосфата. Механизм реакции нельзя объяснить совместным действием рацемазы аланина и D-трансаминазы, поскольку ни пируват, ни а-кето - - метилтиомасляная кислота на нее не влияют. [16]
К ферментам изомеризации относят также группу ферментов, которая катализирует стереоизомеризацию органических соединений. Эти ферменты называют стереоизомеразами, или рацемазами. [17]
Был получен мутант Pseudo-monas fluorescens, у которого отсутствовал фермент рацемаза ( фермент /), катализирующий взаимопревращение двух оптических изомеров. Больше никаких ферментов индуцировано не было. [18]
Вызывают реакцию инверсии асимметричных групп, сопровождающуюся измевением направления вращения плоскости поляризованного света. Ферменты, которые действуют на субстраты с одним асимметрическим атомом, называются рацемазами. К ним принадлежат, например, бактериальные ферменты аминокислот, превращающие L-аминокислоты в D-аминокислоты. Ферменты, действующие на субстраты с несколькими асимметрическими атомами; называются эпимеразами. [19]
Ряд ферментов обнаружены только у микроорганизмов. К таким ферментам относятся: танназа, расщепляющая дигаллат до галловой кислоты, рацемазы многих аминокислот, кератиназы, гидролизующие серусодержащие белки - кератины, входящие в состав волоса, перьев, рогов и копыт. Некоторые микроорганизмы обладают специфическими декарбоксилазами аминокислот, образуют пенициллина - - зу7 расщепляющую пенициллин до пенициллиновой кислоты и воды. Характерной особенностью некоторых бактерий является их способность окислять неорганические субстраты: аммиак, нитриты, сульфид и другие соединения серы, а также двухвалентное железо, что связано с наличием у них особых ферментов. [20]
В результате осуществляемого аланинрацемазой взаимопревращения D - и L-аланина клетка располагает обоими этими изомерами. Хотя основное внимание привлекла роль рацемазы в образовании D-аланина, возможны ситуации, при которых рацемаза катализирует образование необходимого для роста L-аланина. В клетках Bacillus subtilis и некоторых других организмов, синтезирующих внеклеточную полиглутаминовую кислоту преимущественно D-конфигурации, D-аминокислоты образуются исключительно под действием аланинрацемазы. Экспериментальные данные свидетельствуют о том, что в клетках этих бактерий из L-аланина под действием аланинрацемазы образуется D-аланин. Далее путем переаминирований между D-аланином и а-кетоглутаровой кислотой образуется D-глутами-новая кислота ( стр. Весьма любопытно, что эти бактерии, столь нуждающиеся в D-глутаминовой кислоте, не располагают рацемазой глутаминовой кислоты. [21]
Интересно отметить множественные функции еноилгидразы. Этот фермент не только гидратирует двойные связи, но действует, кроме того, как цис-транс-изоыераза и рацемаза. Сообщалось также, что еноилгидратаза катализирует реакции изомерии положения, превращая р у-ненасыщенные производные КоА в а р-ненасыщенные производные. [22]
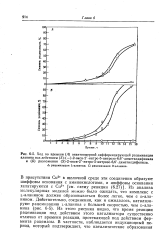 |
Ход во времени ( А энантиомернои дифференцирующей рацемизации. [23] |
Из анализа молекулярных моделей можно было ожидать, что комплекс с ь-аланином должен образовываться более легко, чем с о-ала-нином. Из этого рисунка видно, что время реакции рацемизации под действием этого катализатора существенно отлично от времени реакции, протекающей под действием фермента рацемазы. [24]
Рацемизация а-аминокислоты обусловлена обратной р-цней нестереоспецифич. Рацемазы аминокислот играют существенную роль у бактерий, синтезирующих из Ь - изомеров О-аланин и О-глу-таминовую к-ту, необходимые для синтеза пептидогликанов. [25]
Таким образом, рацемизация L-аминокислот может происходить в начальном периоде вдвое быстрее, чем о-аминокислот. На рис. 6 - 4 показано хорошее совпадение экспериментальных ( точки) и вычисленных ( кривые) величин, полученных путем интегрирования уравнения (6.26) с использованием величин KL, VL, Къ и VD, определенных ранее. Ясно, что рацемаза действительно обладает энантиомерной дифференцирующей способностью и действует подобно другим ферментам. [26]
Изомеразы катализируют различные типы оптических, геометрических и позиционных изомеров. Если изомеризация включает внутримолекулярный перенос группы, то фермент получает название му-тазы. К классу изомераз относят также рацемазы и эпимеразы. [27]
О роли D-аминокислот в биологических объектах судить довольно трудно; наличие их в природе позволяет подвести по крайней мере телеологическое основание под существование D-аминокислотной оксидазы ( стр. Существуют и другие ферментные системы, осуществляющие обмен D-изомеров. Очевидно, что D-аминокислоты могут образоваться при действии аминокислотных рацемаз бактерий ( стр. Остатки D-аминокислот, входящие в состав некоторых антибиотиков, придают молекулам последних повышенную устойчивость, делая их менее доступными воздействию пептидаз. В связи с этим интересно отметить, что глутаминовая кислота, входящая в состав клеточных белков В. L-конфигурацию, тогда как глутаминовая кислота, выделенная из клеточных капсул, является D-изомером. Предположение о том, что биологическая активность некоторых антибиотиков обусловлена наличием в их молекуле остатков D-аминокислот, лишено фактического основания. [28]
Изомеразы катализируют реакции внутримолекулярной перегруппировки, причем состав субстрата не изменяется. Эти реакции не выделяют и не поглощают энергии и служат обычно для подготовки субстрата к дальнейшим превращениям. Если изомераза катализирует превращение конфигурации замещающей группы при асимметрическом атоме углерода, то она носит название рацемазы или мутаротазы. Известны, например, рацемазы аминокислот у бактерий, катализирующие взаимную замену форм d - и / - аминокислот при участии пири-доксальфосфата в качестве кофермента. [29]
Общие пути превращения аминокислот включают реакции дезаминиро-вания, трансаминирования, декарбоксилирования, биосинтеза и рацемизации. Рассмотрим подробно первые четыре реакции, имеющие значение для всех живых организмов. Реакции рацемизации характерны только для микроорганизмов; открыты ферменты, катализирующие рацемизацию ряда аминокислот ( Ала, Глу, Про, Мет, Лиз, Сер) и эпимеризацию оксипролина и а е-диаминопимелиновой кислоты. Физиологическая роль рацемаз микроорганизмов сводится, вероятно, к синтезу D-изомеров аминокислот для построения клеточной оболочки. [30]
Страницы: 1 2 3