Значение - мольный объем
Cтраница 3
Эта проекция никак не отражает мольного объема. Для того чтобы найти значения мольных объемов при различных условиях, необходимо построить диаграммы, одной из осей которых является ось мольных объемов, пожертвовав явным отображением какой-либо другой величины. [31]
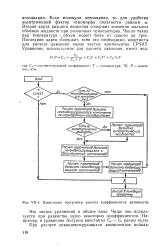 |
U-4. Блок-схема программы расчета коэффициентов активности. [32] |
Если молекула неполярная, то для удобства ацентрический фактор гомоморфа полагается равным со. Вторая карта каждого вещества содержит значения мольных объемов жидкости при различных температурах. Число таких пар температура - объем может быть от одного до трех. [33]
Методом вытеснения измерены мольные объемы метана при давлениях от 10 000 атм и температурах 50 - 400 С. По уравнению состояния Тэйта определены значения мольных объемов метана и его термодинамические свойства. На основе уравнения Тейта и известных термодинамических соотношений рассчитаны энтропия, энтальпия и летучесть метана. [34]
Расстояние между ними при постоянном давлении и есть количество молей газа ( Д / гР г), вытесненное из пьезометра вкладышем при данных давлении и температуре. По уравнению ( 1) рассчитывают значения мольных объемов газа при различных давлениях и температуре опыта. [35]
Поскольку Ле Ба не учитывал этот эффект, его значения мольного объема, рассчитанные по атомным вкладам, всегда больше по срав - - нению с найденными Траубе, и такие величины обладают незначительной практической ценностью. [36]
Поскольку Ле Б а не учитывал этот эффект, его значения мольного объема, рассчитанные по атомным вкладам, всегда больше по сравнению с найденными Траубе, и такие величины обладают незначительной практической ценностью. Однако до сих пор метод Ле Ба описывается в руководствах. [37]
Действительно, уже давно известно правило Коппа, используя которое можно рассчитать приближенное значение мольного объема жидкости при температуре кипения. Позднее различными авторами были предложены таблицы более точных долей для вычисления значений мольного объема жидкостей. [38]
Чем большему давлению подвергнута жидкость, тем выше ее температура кипения, тем больше плотность ее насыщенного пара и соответственно меньше мольный объем пара. При повышении температуры изобарные участки изотерм, ограниченные слева и справа значениями мольных объемов жидкости и пара, становятся все короче и, наконец, смыкаются в точку ( точка К на рис. 3), где плотность жидкости и плотность насыщенного пара равны. Вся область равновесия жидкости и пара располагается, таким образом, под изобарой рк, проходящей через критическую точку К. Вся область жидкого состояния расположена под изотермой / к - Чтобы сконденсировать газ в жидкость, надо, следовательно, охлаждать его до температуры ниже критической. При этом достаточно подвергнуть газ давлению, немного большему, чем критическое давление рк, и весь газ сконденсируется в жидкость; при меньшем давлении может существовать одновременно и жидкая и газообразная фаза. [39]
Определение коэффициента активности и смешанного вириального коэффициента осуществляется путем графической экстраполяции к нулевому давлению. Значения Вп имеются в литературе, при отсутствии величин и они с определенным приближением заменяются значениями мольного объема сорбата. [40]
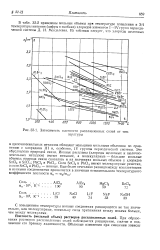 |
Зависимость плотности расплавленных солей от температуры. [41] |
Это обусловлено природой связи. Ионные расплавы ( хлориды щелочных и щелочноземельных металлов) имеют меньшие, а молекулярные - большие мольные объемы; природа связи сказалась и на значениях мольных объемов у хлоридов SnCl4 и SnCl2; РЬС14 и PbCL. Соли SnCl4 и РЬС14 имеют молекулярные решетки, а соли SnQ2 и PbCL - ионные. [42]
По полученным уравнениям на ЭВЦМ были рассчитаны изотермические изменения энтропии, энтальпии и отношения летучестей. Далее, приняв состояние идеализированного метана при 0 С и 1 атм за стандартное, мы вычислили ( для расчетов использовались литературные данные [5] о значениях мольных объемов СН4 при давлениях до 2000 атм) изменение указанных функций при сжатии метана до 2000 атм, а затем и суммарное изменение энтальпии, энтропии и летучести при сжатии метана да 10 000 атм при всех температурах. [43]
Для идеального газа мольный объем при нормальных условиях равен ( 22 4138 0 0070) л / моль. Мольные объемы реальных газов различны и несколько отличаются от этого значения; однако в большинстве случаев различие сказывается лишь в четвертой и последующих значащих цифрах. Поэтому для реальных газов следует пользоваться значением 22 4 л / моль либо ( если нужна более высокая точность) значением мольного объема изучаемого газа. [44]
Значение мольного объема обычно представляет меньший интерес, чем значения других перечисленных величин. Подобная трехмерная диаграмма представляет собой проекцию полной четырехмерной диаграммы на трехмерное пространство в указанных осях. Эта проекция никак не отражает мольного объема. Для того чтобы найти значения мольных объемов при различных условиях, необходимо строить диаграммы, одной из осей которых является ось мольных объемов, приняв в качестве функции независимых переменных какую-либо другую величину. [45]
Страницы: 1 2 3 4