Относительная реакционность
Cтраница 2
Данные по совместной полимеризации не позволяют сделать какие-либа выводы об относительной реакционности различных радикалов по отношению к какому-нибудь одному мономеру. Эти данные могут быть получены путем сопоставления констант совместной полимеризации с абсолютными значениями констант роста цепи для отдельных мономеров. [16]
Данные по совместной полимеризации не позволяют сделать какие-либо выводы об относительной реакционности различных радикалов по отношению к какому-нибудь одному мономеру. Эти данные могут быть получены путем сопоставления констант совместной лолимеризации с абсолютными значениями констант роста цепи для отдельных мономеров. [17]
Данные по совместной полимеризации не позволяют сделать какие-либо выводы об относительной реакционности различных радикалов по отношению к какому-нибудь одному мономеру. [18]
Известно довольно много реакций, которые позволяют непосредственно из опытных данных определить относительную реакционность валентнонасыщенных молекул по отношению к какому-либо радикалу. Многие из этих реакций были рассмотрены в предыдущих главах. [19]
Необходимо поэтому индивидуализировать понятие подвижности галоида указанием на характер реакции, применительно к которой изучается относительная реакционность галоидного атома. [20]
Определение выходов метана АСН4 и этана АС2Нв в присутствии и в отсутствие RH позволяет найти отношение констант kg / k f, которое характеризует относительную реакционность различных углеводородов. [21]
Определение выходов метана ЛСЩ и этана АС2Н6 в присутствии и в отсутствие RH позволяет найти отношение констант ks / k 2, которое характеризует относительную реакционность различных углеводородов. [22]
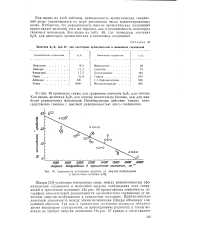 |
Зависимость метального сродства от энергии возбуждения в триплетное состояние. [23] |
На рис. 56 представлена зависимость логарифма относительной реакционности ароматических соединений от величины энергии возбуждения в триплетное состояние. Приблизительно линейную зависимость между этими величинами Шварц объясняет следующим образом. Так как в триплетном состоянии молекула обладает двумя непарными электронами, то присоединение радикала к такой молекуле не требует энергии активации. [24]
Данные, приведенные в табл. 31, 33 и 34, имеют много общего. Для удобства их сравнения в табл. 35 приведены относительные реакционности атомов водорода в различных углеводородах по отношению к исследованным радикалам. [25]
А, аналогичный смысл имеют и константы k с другими индексами. A, и kn i / k A, представляют относительные реакционности валентнонасыщенных молекул по отношению к радикалам Ri и R2, АО - молекула, принятая в качестве стандарта сравнения, п - постоянная. [26]
А, аналогичный смысл имеют и константы k с другими индексами. & RlA и & Й Аi / RjA, представляют собой относительные реакционности валентнонасыщенных молекул по отношению к радикалам Rx и R2; A0 - молекула, принятая в качестве стандарта сравнения; п - постоянная. [27]
А, аналогичный смысл имеют и константы k с другими индексами. Величины k A k A, и k Jk, представляют относительные реакционности валентнонасыщенных молекул по отношению к радикалам Ri и Rz, АО - молекула, принятая в качестве стандарта сравнения, п - постоянная. [28]
В качестве ацилирующих средств находят применение некоторые кислоты, ангидриды кислот, хлорангидриды и в некоторых случаях другие производные кислот, как, например, амиды и эфпры. Выбор того или иного ацилирующего средства в значительной мере зависит от относительной реакционности ацилируемого соединения. Аминосоедннения при прочих равных условиях ацилируются легче, чем оксисоединения. Поэтому если для ацилированпя первых применяются нередко кислоты, то для ацилирования фенолов они, как правило, непригодны, и в этом случае пользуются более реакционно-способными ангидридами н особенно хлорангидридами. [29]
В качестве ацилирующих средств находят применение некоторые кислоты, ангидриды кислот, хлорангидриды и в некоторых случаях другие производные кислот, как, например, амиды и эфиры. Выбор того или иного ацилирующего средства в значительной мере зависит от относительной реакционности ацилируемого соединения. Аминосоединения при прочих равных условиях ацилируются легче, чем оксисоединения. Поэтому если для ацилирования первых применяются нередко кислоты, то для ацилирования фенолов они, как правило, непригодны, и в этом случае пользуются более реакционно-способными ангидридами и особенно хлорангидридами. Разумеется, в производстве предпочитают пользоваться наиболее доступными и дешевыми ацилирующими средствами, особенно в тех случаях, когда введение ацила имеет лишь вспомогательное значение. [30]
Страницы: 1 2