Реакция - дэкин
Cтраница 2
По своей реакционной способности перекись водорода в щелочном растворе отличается от других реагентов в реакции Байера - Виллигера. Для проведения реакции Дэкина и для расщепления а-дикетонов следует предпочесть щелочную среду. Однако при работе с а, - непредельными кетонами применение, этих условий приводит исключительно к образованию эпокси-кетонов, а не продуктов реакции Байера - Виллигера. Было бы желательно получить дальнейшие сведения о течении и кинетике реакций, проводимых с применением перекиси водорода в щелочной среде. [16]
По своей реакционной способности перекись водорода в щелочном растворе отличается от других реагентов в реакции Байера - Виллигера. Для проведения реакции Дэкина и для расщепления а-дикетонов следует предпочесть щелочную среду. Однако при работе с а, - непредельными кетонами применение этих условий приводит исключительно к образованию эпокси-кетонов, а не продуктов реакции Байера - Виллигера. Было бы желательно получить дальнейшие сведения о течении и кинетике реакций, проводимых с применением перекиси водорода в щелочной среде. [17]
По своей реакционной способности перекись водорода в щелочном растворе отличается от других реагентов в реакции Байера - Виллигера. Для проведения реакции Дэкина и для расщепления а-дикетонов следует предпочесть щелочную среду. Было бы желательно получить дальнейшие сведения о течении и кинетике реакций, проводимых с применением перекиси водорода в щелочной среде. [18]
В случае оксиальдегидов с объемистыми алкильными заместителями 58 наблюдается сильное замедление реакции. Это, по-видимому, вызвано тем, что подобные оксиальдегиды в щелочной среде ( условия реакции Дэкина) существуют преимущественно в диено-ново-енолятной форме. [19]
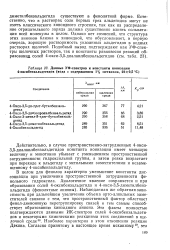 |
Данные УФ-спектров и константы ионизации 4-оксибензальдегидов ( вода с содержанием 1 % метанола, 22 0 5 С. [20] |
В целом для фенолов характерно уменьшение константы диссоциации при увеличении пространственной затрудненности фе-нольного гидроксила. Наблюдаемая же обратная зависимость при дальнейшем увеличении объема орто-алкильных заместителей связана с тем, что пространственный фактор облегчает фенол-диеноновую перегруппировку связей и тем самым способствует образованию хиноидного аниона. Наиболее характерна в этом отношении реакция Дэкина. [21]
Алифатические и ароматические альдегиды при взаимодействии с надкислотами обычно превращаются в кислоты. Окисление ароматических альдегидов, содержащих в о - или п-положении метоксильную или гидроксильную группу, перекисью водорода в щелочной среде протекает с замещением альдегидной группы гидроксильной. Данный метод, являющийся модификацией окисления по Байеру-Виллигеру, известен под названием реакции Дэкина ( стр. [22]
Более сложно протекает окисление 1 3-дикетонов, р-кето-эфиров и енолацетатов. Во многих случаях образующиеся вначале продукты окисления ( перекиси, эфиры, лактоны, ангидриды) подвергаются дальнейшим превращениям. Образование эфиров, лактонов и ангидридов при окислении карбонильных соединений с помощью перекиси водорода и надкислот показывает, что эта реакция включает в себя внутримолекулярную перегруппировку, при которой радикал, первоначально связанный с атомом углерода карбонильной группы, переходит к кислороду. В иностранной литературе эту реакцию обычно называют перегруппировкой Байера-Виллигера. Частным случаем перекисного окисления карбонильных соединений является так называемая реакция Дэкина [ 21, состоящая в окислении о - и / г-оксибензальдегидов и о - и п-оксиацетофенонов перекисью водорода в щелочной среде и являющаяся одним из препаративных методов получения пирокатехина, гидрохинона и их производных. [23]
Страницы: 1 2