Реакция - железо
Cтраница 1
Реакции железа и его сплавов с водой в сверхкритической области ( например, при 225 ат и 374 С) аналогичны реакциям в паровых котлах. Они представляют интерес в диапазоне между 240 и 300 С для водяных атомных реакторов. Особенно высокие требования ставятся в отношении чистоты воды. [1]
Реакция железа с водою обратима. Накаливая окалину в струе водорода, получают воду и железо. Отсюда, по принципу химических равновесий, если ввять железо и водород и прибавить кислород, но в таком количестве, чтобы его не достало для соединения с тем и другим веществом, то кислород разделится, часть его соединится с железом, другая с водородом, во часть их останется в несоединенном виде. Если в замкнутом пространстве вместить железо и воду, то при накаливании до температуры начала реакции произойдет разложение воды, но оно прекратится, не дойдет до конца, потому что получатся условия для обратной реакции и равновесие наступит после разложения некоторого количества воды. Обратимость здесь опять связана с малым тепловым аффектом и опять обе реакции ( прямая и обратная) идут здесь при накаливании. Но если выделяющийся водород, в выше написанной реакции, удаляется, то от образования его не возрастает парциальное его давление, а потому все железо может быть водою окислено. В атом видны начала того влияния масс, к которому неоднократно придется возвращаться в дальнейшем изложении. [2]
Реакции железа и его сплавов с водой в сверхкритической области ( например, при 225 ат и 374 С) аналогичны реакциям в паровых котлах. Они представляют интерес в диапазоне между 240 и 300 С для водяных атомных реакторов. Особенно высокие требования ставятся в отношении чистоты воды. [3]
Реакция железа ( II) с перманганатом протекает гладко, быстро и до конца. В присутствии соляной кислоты наблюдаются, однако, завышенные результаты вследствие окисления хлорид-иона перманганатом. Эта реакция обычно протекает недостаточно быстро и не приводит к серьезным ошибкам, но в присутствии железа ( II) она ускоряется. Поэтому проводят предварительное удаление хлорида упариванием с серной кислотой или применяют реагент Циммермана - Рейнгардта. Последний представляет собой раствор марганца ( II) в достаточно концентрированных серной и фосфорной кислотах. [4]
Реакция железа с молекулярной водой Fe HzO FeO - f - На, по-видимому, характерна лишь для случая прямого контакта железа с водяными парами. [5]
Тиоцианатная реакция железа позволяет обнаружить в растворе тиоцианат при концентрации порядка 10 моль / л, что соответствует 0 01 мл 0 1 М KSCN в 100 0 мл раствора. [6]
Тиоцианатная реакция железа позволяет обнаружить в растворе тиоцианат при концентрации порядка 10 моль / л, что соответствует 0 01 мл 0 1 M KSCN в 100 0 мл раствора. [7]
При реакции железа с уксусной кислотой образуется ацетат железа. Продукты химической коррозии, откладываясь на металле в виде пленки, замедляют и со временем стабилизируют процесс коррозии. Интенсивность дальнейшего разрушения находится в прямой зависимости от эррозионного воздействия внешней среды и прочности образовавшейся пленки окислов. Химическая коррозия металла обычно наблюдается в сухих газах и в неэлектролитах и на практике встречается сравнительно редко. [8]
Такие реакции железа ( П) используются в аналитической химии наиболее часто. [9]
Диаграмма возможных электронных реакций железа позволяет сде-дать некоторые предположения об электрохимическом поведении железа, обосновать условия стойкости металлической фазы. [10]
При рассмотрении реакций железа ( П) следует учитывать другой фактор: ускорение электронного обмена между железом ( П) и железом ( Ш) многими анионами. Тем не менее истинные скорости обмена можно измерить, применяя методы меченых атомов и замораживания. [11]
К первому относится реакция железа с салициловой кислотой, приводящая к исчезновению свечения реагента. Реакции этого типа нечувствительны и неспецифичны. Эта реакция также малочувствительна. Медь и кобальт являются катализаторами этой же реакции при меньших концентрациях, чем железо. [12]
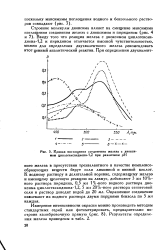 |
Кривая поглощения соединения железа с диоксимом циклогександиона-1 2 при различном рН. [13] |
Ввиду того что реакция железа с диоксимом циклогексан-диона-1 2 и пиридином отличается высокой чувствительностью, можно для определения двухвалентного железа рекомендовать этот ценный аналитический реактив. [14]
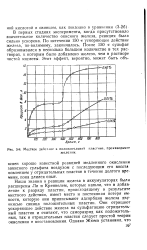 |
Местное дейсг. ше в положительной пластине, производимое. [15] |
Страницы: 1 2 3 4