Реакция - ион - водород
Cтраница 2
В тех случаях, когда в уравнении реакции при превращении - окисленной формы в восстановленную имеются стехиометрические коэффициенты, не равные единице, они входят в уравнение Нернста в качестве показателей степени для соответствующих концентраций. Кроме того, часто превращение окисленной формы в восстановленную сопровождается глубоким изменением состава иона окислителя или восстановителя, что происходит при участии в реакции ионов водорода ч тогда величина потенциала электрода будет также зависеть и от концентрации ионов Н в растворе. [16]
Среднее время жизни, найденное по форме линии, составляет величину порядка 0 1 сек. Затем найдена константа скорости обмена ( причем были известны константы равновесия, а следовательно, и концентрации); она равна примерно 1011 л-молъ 1-сек 1 с небольшим температурным коэффициентом. Эта величина подобна значениям для реакций ионов водорода в воде, лимитируемых диффузией ( стр. [17]
По теории действия органических аналитических реагентов проводятся в последние 10 - 15 лет очень обширные и глубокие исследования. В Институте общей и неорганической химии Академии наук Украины ( ИОНХ АН УССР) В. А. Назаренко систематически изучает химизм взаимодействия многозарядных ионов металлов с органическими реагентами. Предложены способы позволяющие оценивать число вытесняемых при реакции ионов водорода. Близкие по направлению работы ведет группа М 3 Ям-польского в Курском педагогическом институте. [18]
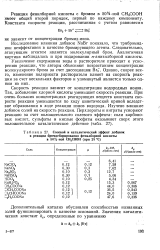 |
Солевой и каталитический эффект добавок. [19] |
Скорость реакции зависит от концентрации водородных ионов. Так, добавление хлорной кислоты уменьшает скорость реакции. При очень больших концентрациях реагирующих веществ константа скорости реакции уменьшается по ходу кинетической кривой вследствие образования в ходе реакции ионов водорода. Изучено влияние добавок солей на скорость реакции. [20]
В связи с тем, что моногидрат НСО4 - Н2О, или [ НО31 - СЮ4, соответствует 85 % - ной кислоте, расплавленный перхлорат оксо-ния должен содержать часть соединения в ковалентной форме. Хотя, как было указано выше, при перегонке под атмосферным давлением происходит некоторое разложение азеотропного раствора, содержащего 72 4 % НСЮ4, растворы водной хлорной кислоты стабильны по отношению к теплу, нагреванию и детонации. Водные растворы, содержащие менее 75 % НС1О4, могут храниться без изменения бесконечно долго при обычных температурах. При обычных температурах водная кислота не является окислителем-ее свойства характерны для концентрированной кислоты и связаны с реакцией иона водорода. Однако горячая концентрированная кислота действует как сильный окислитель, в результате происходит восстановление аниона перхлората. [21]
Для этого отвешивают на аналитических весах нужное количество смеси. Титрование ионов железа ( III) проводят комплексоном III. Когда повышение электропроводности раствора сменится понижением, заканчивают первое титрование. При титровании ионов железа ( III) комплексоном III в присутствии кислоты электропроводность раствора до точки эквивалентности повышается менее сильно, чем при титровании раствора, не содержащего кислоту. Также менее резко выражено понижение электропроводности раствора после первой точки эквивалентности. Это объясняется тем, что раствор с начала титрования имеет высокую электропроводность и повышение электропроводности от выделяющихся при реакции ионов водорода менее сильно сказывается. С другой стороны, на фоне высокоэлектропроводного раствора менее сильно сказывается понижение концентрации ионов водорода в связи с их взаимодействием с Н2У2 - - ионами после точки эквивалентности. При втором титровании до точки эквивалентности, соответствующей окончанию титрования катионов кобальта, электропроводность раствора немного понижается, а после нее немного увеличивается. [22]
Страницы: 1 2