Реакция - класс
Cтраница 2
В литературе механизм изотопного обмена 5в обыкновенно называют ионизационным или диссоциативным, а механизм SE % - электрофильным или ассоциативным. Эта терминология неудачна по ряду причин, в частности, потому, что все известные теперь нерадикальные реакции водородного обмена, а не только реакции класса SE %, относятся к типу электрофильных. [16]
Значительно труднее изыскание новых ранее неизвестных катализаторов даже для сравнительно простых и каталитически изученных реакций. Между тем электронные представления в катализе и установленные закономерности, связывающие электронно-физические свойства твердых тел с каталитическими, могут оказать реальную пользу в изыскании новых и улучшении известных катализаторов для реакции редоксного класса. [17]
Экспериментальные ( прямые или косвенные) данные того времени свидетельствовали о том, что экзотермические реакции первого класса протекают без энергии активации и при эндотермическом направлении энергия активации равна теплоте реакции. Как мы теперь знаем, такие реакции в действительности представляют довольно редкое исключение ( например, Н 02 ОН О - 16 7 ккал / молъ, Е 16 73 0 25 ккал / молъ) [9] и подавляющее большинство бимолекулярных реакций, которые можно отнести к реакциям класса I, имеют отличную от нуля истинную энергию активации, правда, обычно составляющую незначительную величину. В отличие от реакций класса I реакции класса II всегда требуют затраты энергии на возбуждение реагентов, намного превосходящей теплоту реакции, даже при экзотермическом направлении реакции. Нужно сказать, что это заключение для многих реакций остается в силе и в настоящее время. [18]
Реакции класса 1, относящиеся к типам а и б, различаются тем, что в реакциях а продукт R-СО-В более устойчив, чем исходное соединение R-СО-X ( в исследуемой области рН), в то время как для реакций б справедливо обратное. Поэтому реакции типа б являются истинно каталитическими реакциями, включающими образование кинетически нестабильного промежуточного ацилпроизводного. В реакциях класса 2 типа а кислотные или основные агенты облегчают замещение группы X в соединении R-СО-X гидроксильной группой воды, приводящее непосредственно к образованию продуктов гидролиза. В реакциях типа б ( класс 2) роль замещенного агента выполняет не вода, а другой основной агент. [19]
Экспериментальные ( прямые или косвенные) данные того времени свидетельствовали о том, что экзотермические реакции первого класса протекают без энергии активации и при эндотермическом направлении энергия активации равна теплоте реакции. Как мы теперь знаем, такие реакции в действительности представляют довольно редкое исключение ( например, Н 02 ОН О - 16 7 ккал / молъ, Е 16 73 0 25 ккал / молъ) [9] и подавляющее большинство бимолекулярных реакций, которые можно отнести к реакциям класса I, имеют отличную от нуля истинную энергию активации, правда, обычно составляющую незначительную величину. В отличие от реакций класса I реакции класса II всегда требуют затраты энергии на возбуждение реагентов, намного превосходящей теплоту реакции, даже при экзотермическом направлении реакции. Нужно сказать, что это заключение для многих реакций остается в силе и в настоящее время. [20]
Экспериментальные ( прямые или косвенные) данные того времени свидетельствовали о том, что экзотермические реакции первого класса протекают без энергии активации и при эндотермическом направлении энергия активации равна теплоте реакции. Как мы теперь знаем, такие реакции в действительности представляют довольно редкое исключение ( например, Н 02 ОН О - 16 7 ккал / молъ, Е 16 73 0 25 ккал / молъ) [9] и подавляющее большинство бимолекулярных реакций, которые можно отнести к реакциям класса I, имеют отличную от нуля истинную энергию активации, правда, обычно составляющую незначительную величину. В отличие от реакций класса I реакции класса II всегда требуют затраты энергии на возбуждение реагентов, намного превосходящей теплоту реакции, даже при экзотермическом направлении реакции. Нужно сказать, что это заключение для многих реакций остается в силе и в настоящее время. [21]
Значительно расширился также круг твердых неорганических катализаторов для реакций кислотно-основного класса [6] и появились новые большие группы органических и металлоорганических катализаторов для реакций разных классов. [22]
Ход истории в классовом обществе определяется взаимоотношениями классов, интересами классов. Чтобы эти фразы не казались лишенными содержания ( какие там классы, когда миллионы людей имеют каждый свою судьбу, желание и возможности), вспомните статистическую природу стимулов к поступкам. Вполне правомерно говорить об интересе, о стремлении и реакции класса или группы людей именно потому, что все характеристики и оценки поведения их ложатся на гауссовы кривые с достаточно острым максимумом. [23]
Главной характеристикой поглощения света комплексом с переносом заряда является то, что оно вызывает переход электрона, в основном принадлежащего донору, к молекуле акцептора. Поэтому справедливо ожидать, что при фотохимической реакции возврат в исходное состояние путем флуоресценции или без испускания поглощенной энергии не будет происходить в значительной степени. Поскольку при поглощении света образуется дирадикальная ионная пара с перенесенным зарядом, которая существенно отличается от дирадикальной ионной пары, полученной термическим путем, фотохимические реакции ( реакции класса Р) будут рассмотрены отдельно. [24]
Главное возражение, которое может быть выдвинуто против окислительно-восстановительного метода класса 1, заключается в ограниченной специфичности. Трудности могут быть обусловлены нестехиометрическими реакциями и удалением избытка окислителя или восстановителя, который был применен для перевода вещества в реактивную форму. Подобные трудности могут встречаться также и в прямых методах. Реакции класса 2 могут также не обладать специфичностью, и при рассмотрении кривой поглощения может быть не ясно, какое вещество участвует в реакции. [25]
На экране тренажера показывают видеофрагмент опроса учащихся на уроке. К доске вызывают несколько учащихся. С классом проводят фронтальную беседу. Показывают реакцию класса, прослушивают ответы учащихся на вопросы. В зависимости от словесного комментирования студентом ответа ученика включают тот или иной вариант реакции класса и вызванного ученика. Возможна демонстрация разных вариантов ответа ученика и реакции класса на этот ответ. [26]
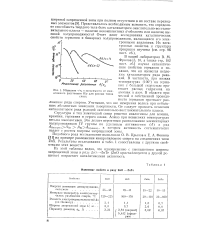 |
Убывание v / v0 в зависимости от межатомного расстояния Rja для разных типов связи. [27] |
В частности, при низких температурах ( 100) на германии с большой скоростью протекает распад гидразина на аммиак и азот. В области примесной и собственной проводимости германия протекает разложение ряда спиртов. Учитывая, что все измерения велись при небольших абсолютных значениях поверхности, Ge следует признать неплохим катализатором ряда реакций окислительно-восстановительного класса. [28]
Ниже будет показано, что основную роль в этих реакциях играет поведение растворителя. Это обстоятельство позволяет на начальных этапах проводить расчет для гетерогенных и гомогенных реакций одновременно. В основе его теории лежит предположение, что энергия активации целиком обусловлена франк-кондоновским барьером. Эта идея впервые была высказана в работе Либби [5] в 1952 г. и физически означает, что изменение электронного состояния происходит при такой конфигурации атомов растворителя, когда электронные термы начального и конечного состояний пересекаются. Поскольку, согласно определению, для реакций класса III существенную роль играют лишь атомы растворителя, находящиеся вне первой координационной сферы, для описания среды с удовлетворительной точностью можно использовать модель диэлектрического континуума. Пользуясь методами термодинамики неравновесных состояний, Маркус вычислил свободную энергию активации; оказалось, что она соответствует экспериментальной величине. Для количественной оценки удельной константы скорости реакции Маркус полагал, что практически все окислительно-восстановительные реакции протекают адиабатически. Использованный Маркусом термодинамический метод наряду с некоторыми достоинствами обладает тем дефектом, что он не позволяет вычислить ток обмена; в рамках этого метода нельзя учесть различия между реакциями на металлах и полупроводниках. [29]
На экране тренажера показывают видеофрагмент опроса учащихся на уроке. К доске вызывают несколько учащихся. С классом проводят фронтальную беседу. Показывают реакцию класса, прослушивают ответы учащихся на вопросы. В зависимости от словесного комментирования студентом ответа ученика включают тот или иной вариант реакции класса и вызванного ученика. Возможна демонстрация разных вариантов ответа ученика и реакции класса на этот ответ. [30]
Страницы: 1 2 3