Реакция - клаус
Cтраница 2
 |
Зависимость степени конверсии H2S т от времени пребывания газа в термической ступени т при соотношении воздух. газ. [16] |
Основная часть тепла, получаемая по реакции Клауса на промышленных установках, рекуперируется, за счет чего производится водяной пар. [17]
Основная часть теплоты, получаемая по реакциям Клауса на промышленных установках, рекуперируется и получается водяной пар. [18]
 |
Зависимость степени конверсии H2S т ] от времени пребывания газа в термической ступени т при соотношении воздух. газ. [19] |
Описанные реакции в технической литературе именуются реакциями Клауса, по имени ученого, предложившего их механизм. [20]
В I группу входят процессы, основанные на реакции Клауса - превращении H2S и SO2 в элементную серу. [21]
Наиболее распространены процессы: низкотемпературные, основанные на реакции Клауса ( Сульфрен и др.); абсорбционные - с предварительным сжиганием отходящих газов ( Акваклаус, ФИН-2 и др.); адсорбционные, основанные на каталитич. [22]
Так как восстановление тиосульфата сероводородом является лимитирующей стадией реакции Клауса в водных растворах, эта стадия в целом определяет скорость процесса. Меньше этой величины наблюдается первый порядок, выше - нулевой по концентрации катализатора. [23]
Это связано с термодинамическими ограничениями, накладываемыми на полноту протекания реакций Клауса. Поэтому отходящие газы установок Клауса необходимо подвергать доочистке при температуре ниже точки росы серы ( 188 С), когда термодинамически возможно достижение более высоких степеней превращения. [24]
Экспериментально изучена кинетика сульфатации образцов оксида алюминия, используемых в качестве катализатора в реакции Клауса, и определена количественная корреляция между сульфатацией и удельной поверхностью и содержанием железа в катализаторе. Атомы железа, находящиеся на поверхности структурных ячеек у - А12О3 ( тип - шпинель) и доступные действию окислителей и восстановителей, могут изменять свою валентность, т.е. могут служить донорами или акцепторами электронов, не образуя при этом отдельной фазы, а оставаясь в структуре шпинели. [25]
В зависимости от концентрации сероводорода в кислых газах были разработаны три разновидности технологии, основанные на реакции Клауса ( рис. V-22), в том числе с процессом без рециркуляции, с раздельными параллельными потоками и с процессом прямого окисления. [26]
В связи с тем, что из потока отходящего газа катализатором удаляется практически вся сера, равновесие реакции Клауса сдвигается в сторону полной конверсии H2S и SO2 в серу. [27]
Часто проводят и тот и другой процессы, а газы ( SO2 и H2S) смешивают для проведения реакции Клауса ( разд. [28]
Если в составе остаточных газов отсутствуют заметные количества COS и CS2, то наиболее целесообразны процессы прямой конверсии, основанные на реакции Клауса. [29]
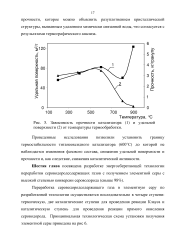 |
Зависимость прочности катализатора ( 1 и удельной поверхности ( 2 от температуры термообработки. [30] |
Страницы: 1 2 3 4