Реакция - паровая конверсия
Cтраница 1
Реакция паровой конверсии СО используется для получения водорода из окиси углерода уже в течение 40 лет. [1]
Поскольку реакция паровой конверсии окиси углерода может протекать при более низкой температуре в пнгтей-лях и коллекторах после выхода газа из труб печи конверсии ( что снижает содержание СО в конвертированном газе), то в данном методе расчета константа равновесия принята при температуре на 10 К выше рабочей температуры ( ПОЗ 10) К. [2]
Тормозящее действие продуктов реакции связано с обратимостью реакции паровой конверсии метана, поэтому более правильно определять скорость реакции по уравнению, предложенному в работе [43], как разность скоростей прямой и обратной реакции. [3]
Для создания реактора одностадийной газификации необходимо одновременно катализировать реакции паровой конверсии оксида углерода и метанирования. [4]
Метод высокотемпературной адсорбционной очистки водорода базируется на совмещении реакции паровой конверсии и адсорбционного удаления СО2 в одном реакционном объеме. [5]
 |
Схема получения водорода с использованием принципа высокотемпературной адсорбционной очистки. [6] |
Новый материал был испытан для сдвига равновесия в реакциях паровой конверсии метана и оксида углерода. На рис. 5 представлена принципиальная схема получения водорода с низким содержанием СО и СО2, которая может быть реализована в малогабаритном автономном устройстве. [7]
Многие органические гетерогенные каталитические реакции, в том числе и реакции паровой конверсии углеводородов, сопровождаются процессами образования углистых веществ, отлагающихся на поверхности или объеме катализаторов и изменяющих их физико-химические и механические свойства. [8]
Состав и выход газа в процессе паро-кислородной газификации алифатических углеводородов определяются из условий равновесия тех же реакций паровой конверсии метана и конверсии окиси углерода, которые определяют состав и выход газа паровой конверсии. [9]
С помощью перечисленных выше уравнений и таблиц методом последовательного приближения на электронно-вычислительных машинах производится расчет условий протекания реакции паровой конверсии углеводородов для современных схем производства водорода. В связи с тем, что в реальных условиях равновесие реакции конверсии СН4 паром не достигается, для практических расчетов Кг принимается по температуре, более низкой, чем температура на выходе из реактора. При проведении процесса под давлением 2 - 3 МПа различие составляет 20 - 30 С. [10]
В условиях процесса единственно вероятными реакциями являются реакции метанирования обоих окислов углерода, а также прямая и обратная реакции паровой конверсии СО. На входе отложение углерода в массе катализатора термодинамически невозможно. На практике образования углерода или окиси углерода не наблюдается. [11]
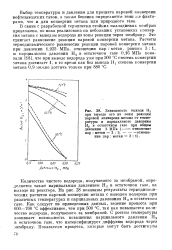 |
Зависимость выхода Н2 при выводе его из зоны реакции паровой конверсии метана от температуры и парциального давления И в остаточном газе при общем. [12] |
В связи с разработкой термически стойких палладиевых мембран предложена, но пока реализована на небольших установках конверсия метана с выводом водорода из зоны реакции через мембрану, dTO сдвигает равновесие реакции паровой конверсии метана. Расчеты термодинамического равновесия реакции паровой конверсии метана при давлении 1 925 МПа, отношении пар: метан равном 6: 1, и парциальном давлении Н2 в остаточном газе O. Mlla показали [18], что при выводе водорода уже при 500 С степень конверсии метана достигает 1, в то время как без вывода Н, степень конверсии метана 0 9 можно достичь только при 880 С. [13]
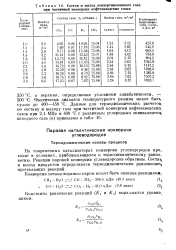 |
Состав и выход конвертированного газа при частичной конверсии нефтезаводских газов. [14] |
На современных катализаторах конверсия углеводородов прач ходит в условиях, приближающихся к термодинамическому равжк весию. Реакции паровой конверсии углеводородов обратимы. Соста и выход продуктов определяются термодинамическим равновесие протекающих реакций. [15]
Страницы: 1 2