Реакция - металл
Cтраница 3
Еще более сложным оказывается реакция металла на эти воздействия. В течение инкубационного периода разрушение носит локальный характер, т.е. зависит в основном от нагружения и деформирования металла в малой окрестности рассматриваемой точки. [31]
Хотя в большинстве случаев реакции металлов, даже с органическими соединениями, по своему характеру являются электролитическими, возможны прямые реакции и другого типа. [32]
Здесь интересно отметить аналогию реакций металлов в низковалентном состоянии с карбенами, имеющими в отличие от обычных свободных радикалов два свободных электрона. [33]
Трехокись является конечным продуктом реакции металла или таких его соединений, как сульфид, с кислородом при нагревании. Трехокиси не взаимодействуют с кислотами, но растворяются в щелочи, образуя растворимый молибдат или вольфрамат, о которых речь пойдет ниже. [34]
Некоторые новые калориметрические исследования реакций металлов с лигандами в водном растворе и обсуждение возможностей и ограничений при использовании калориметрических данных для классификации металлов по типам а и Ъ [ 144а ], для вычисления энергии стабилизации в поле лигандов и для объяснения возникновения высоко - и низкоспиновых комплексов. [35]
Под механическим поведением понимают реакцию металла на тот или иной вид нагружения, что позволяет объединить физические явления, отражающие отклик системы ( деформируемого металла) на механические воздействия. [36]
Трудно обобщать данные о реакциях металлов и сплавов в атмосфере, потому что на них оказывают сильное влияние переменные характеристики загрязненности и влажности воздуха, а также потому, что некоторые поверхностные реакции в значительной степени обусловлены образующимися на воздухе окислами и реакциями металлов с анионами. [37]
В процессе металлической коррозии - реакции металла с неметаллической средой - металл часто находится в контакте с ионным проводником, например раствором электролита. Суммарный процесс состоит из отдельных эквивалентных в фараде-евском смысле анодной и. Поэтому не удивительно, что лучшее понимание анодных реакций металла явилось следствием детального изучения коррозии и родственных процессов. [38]
В процессе металлической коррозии - реакции металла с неметаллической средой - металл часто находится в контакте с ионным проводником, например раствором электролита. Суммарный процесс состоит из отдельных эквивалентных в фараде-евском смысле анодной и катодной реакций, причем коррозионным процессом является именно анодная реакция. Поэтому не удивительно, что лучшее понимание анодных реакций металла явилось следствием детального изучения коррозии и родственных процессов. [39]
Другим примером восстановительного металлирования является реакция металлов с металлоорганическими соединениями, в которых металл менее активен как восстанавливающий агент. [40]
В тех случаях, когда реакция металла с кислотой не приводит к образованию альдегида, а протекает все же с некоторым ускорением, как, например, олова и меди с муравьиной кислотой, ускорение процесса может быть объяснено образованием комплексных солей этих металлов, отличающихся достаточно хорошей их растворимостью, что и способствует коррозии этих металлов. [41]
Осадок другого характера образуется при реакции металлов с кислотами в присутствии воды. [42]
Другим примером восстановительного металлирования является реакция металлов с металлоорганическими соединениями, в которых металл менее активен как восстанавливающий агент. [43]
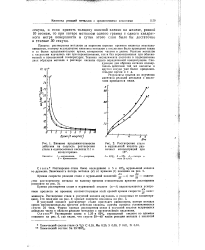 |
Влияние продолжительности.| Растворение стали в муравьиной кислоте различных концентраций при 18. [44] |
Результаты опытов по изучению кинетики реакций металлов с кислотами приводятся ниже. [45]
Страницы: 1 2 3 4