Реакция - белок
Cтраница 1
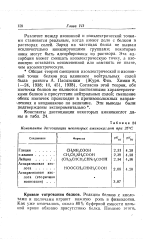 |
Константы диссоциации некоторых аминокислот при 25 С. [1] |
Реакции белков с кислотами и щелочами играют важную роль в физиологии. Как уже отмечалось, около 80 % буферной емкости цельной крови обязано присутствию белка. [2]
Реакции белков с диазосоединениями получили широкое распространение в связи с тем, что о и протекают при низкой температуре и при слабо щелочной реакции, что уменьшает опасность денатурации белков. Ландштейнер [52], используя эту реакцию, приготовил много азобелков, применяемых как специфические антигены. [3]
Реакции белков с другими альдегидами, например с ацеталь-дегидом, или реакция их с глюкозой и другими сахарами ( так называемая реакция побурения) в настоящее время широко исследуются, так как они имеют важное значение в пищевой промышленности. Подобно формальдегиду, ацетальдегид может вступать в реакцию с первичными амино - и индольными группами. Однако эти реакции белков выходят за пределы круга вопросов, рассматриваемых в этой статье. [4]
Реакция белка с медью полиостью завершается за 5 - 10 минут при комнатной температуре. Однако в этой среде реактив Фолина активен лишь короткое время. При добавлении его в смесь с опозданием на несколько секунд наблюдается ослабление окраски. [5]
Реакцию белков и пептидов с ДНФБ и все последующие манипуляции следует проводить в темноте, так как ДНФ-производные на свету разлагаются. [6]
При реакции белка с фенилизотиоцианатом образуется соответствующее фенилтиокарбамильное производное I, которое расщепляется хлористым водородом до фенилтиогидантоина II и модифицированного белка. [7]
Изучение реакции белков и пептидов с метилизотиоцианатом и идентификации ыетилтиогидан-тоинов методом ГЖХ. [8]
Скорости реакций неравновесных белков часто имеют необычную зависимость от температур. Начальная конфигурация и скорость кон-формационной релаксации белков, как правило, более чувствительны к изменениям температуры, чем скорость элементарного акта исследуемого химического превращения. Поэтому, например, с понижением температуры конформационная релаксация замедляется и большая часть реакции успевает закончиться на первых стадиях релаксации, когда реакционную способность белка максимальна. Измеряемая скорость реакции в этом случае возрастает в кажущемся противоречии с законом Аррениуса. [9]
При изучении реакций белков все более широко применяются соединения ртути и мышьяка. [10]
Рассматриваемые в данной главе некоторые реакции белков как азотсодержащих органических веществ приведены в очень ограниченном количестве, так как весьма подробно рассматриваются в курсе биологической химии. [11]
Эти производные аминокислот образуются при разложении продуктов реакции белков или пептидов с феннлизотиоцианатом. Они очень удобны при изучении структур пептидов и позволяют отделить аминокислоты от мешающих анализу соединений. Кроме этого, с появлением усовершенствованного автоматического способа разделения аминокислот стал необходим метод идентификации этих соединений, поскольку за 72 - 90 мин с одним производным можно провести от 10 до 25 операций. В качестве такого быстрого метода идентификации соединений была предложена газовая хроматография; однако в ряде случаев результаты анализа недостаточно однозначны и требуют подтверждения. [12]
Замещение в ароматическом кольце тирозина может быть легко достигнуто при реакции белков с галогенами, азотной кислотой или диазосоединениями. [13]
Наконец, следует отметить, что применение уравнений этого раздела не ограничивается реакциями белков с металлами, но также относится к другим реакциям, при которых наблюдается конкуренция с ионами водорода. [14]
Удаление прочно связанной гидратационной воды приводит к глубоким изменениям белков, и многие реакции белков можно объяснить, учитывая их гидратацию и изменение структуры воды. [15]
Страницы: 1 2