Реакция - обмен - лиганд
Cтраница 2
По химическим превращениям циклопентадиенилметаллкарбонилы и родственные соединения во многом подобны незамещенным карбонилам ( см. гл. Наиболее характерны для них реакции обмена лигандов. [16]
Для разделения используют также реакции обмена лигандов на обменниках, заряженных ионами тяжелых металлов. Поскольку в такой системе должны образовываться комплексы ионов металлов, связанных с ионообменником ( например, комплексы аминокислот и ионов меди, связанных ионообменником), то здесь, как при разделении на ионообменниках полярных органических молекул, например Сахаров, с помощью водно-спиртовых элюентов, нельзя говорить о чистой ионообменной хроматографии. [17]
Для ферроцена и я-циклопеитадиенильных соединений ряда других металлов характерны реакции электрофильного замещения в пятичлеииом цикле. Если в предыдущих разделах данной главы в связи с вопросами металлокомплексного катализа мы рассматривали реакции обмена лигандов и их взаимодействия в координационной сфере металла, то в данном разделе внимание будет сконцентрировано на реакциях замещения водорода в циклопеитадиенильном лиганде на другие функциональные группы. Эти реакции в чисто органическом синтезе практически не используются, поскольку из полученных комплексов очень трудно удалить металл. Таким путем получают разнообразные производные л-циклопеитадиенильных соединений переходных металлов, которые используют затем как таковые, не удаляя металл. [18]
В ряде случаев, например C5H5Ti ( ОС2Н4), и ( G5II5) 2Ti ( OCOCH3) 2 [400], связь Ti - СВН5 разрывается уже при действии этилового спирта при 20 С. В связи с этим наибольшее внимание в химии ЦПДпроизвод-ных титана было обращено нами на реакции обмена лигандов титана и исследование изменения свойств связи Ti - С5Н5 в результате этого обмена. [19]
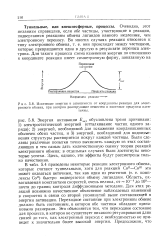 |
Изменение энергии в зависимости от координаты реакции для электронного обмена, при котором реагирующие вещества и конечные продукты идентичны. [20] |
Туннельные, или внешнесферные, процессы. Очевидно, этот механизм справедлив, если обе частицы, участвующие в реакции, подвергаются реакциям обмена лигандов намного медленнее, чем электронному переносу. [21]
Хромовые комплексы тридентатных азокрасителей в связи с их высокой устойчивостью составляют наиболее важную группу металлокомплексных красителей. Это является результатом кинетической инертности [ 721 КОМПЛРКСННХ соединений трехвалентного хрома, которые с трудом вступают в реакцию обмена лигандов. Последнее создает иногда трудности при синтезе комплексов из гидратированных солей трехвалентного хрома. [22]
Триалкилфосфаты - очень сильные ионизирующие растворители, которые образуют с большинством катионов переходных металлов устойчивые шестикоординированные частицы. Диэлектрическая проницаемость ТМР достаточна для того, чтобы в его растворах наблюдалась заметная электролитическая диссоциация. Вследствие высокого донорного числа этого растворителя в нем не осуществляются реакции обмена лигандов, при которых происходит замещение молекул растворителя в координационной сфере слабыми конкурирующими лигандами. Бромид марганца ( П) [77] в этом растворителе подвергается ионизации, так что даже в присутствии избытка ионов брома не было обнаружено никаких бромидных комплексов. Образования же бромованадата ( Ш) не наблюдали. Данные, полученные из спектров, показывают, что образующиеся тет-раэдрические частицы путем дополнительной координации молекул триметилфосфата медленно превращаются в октаэдрические. [23]
Рассмотренные особенности ионных ассоциатов следует объяснять электростатическими эффектами. Влияние на кинетику обмена лигандов ионного ассоциата связано со степенью ассоциации по Бьерруму и, следовательно, как и ассоциация, возрастает с увеличением заряда аниона, образующего соответствующую ионную пару. При этом предполагается, что поле ассоциированных анионов способствует повышению электронной плотности связи М - L в комплексах. В результате скорость реакции обмена незаряженных лигандов ( phen) снижается. В случае отрицательных лигандов сила отталкивания между лигандами комплекса и ионной пары приводит к увеличению скорости обмена. Для хелатного катиона, например [ Fe ( phen) s ] 2, вода из гидратной оболочки может вытесняться ассоциированным анионом, что приводит к снижению скорости гидратации исходного катионного хелата. В настоящее время экспериментальных данных еще недостаточно для того, чтобы делать какие-либо общие выводы. [24]
В колбе на 500 мл, снабженной обратным холодильником Либиха и ртутным затвором, в течение 24 ч нагревают при кипении 11 0 г ( 0 05 моль) Сг ( СО) 6 и 22 5 г ( 0 40 моль) КОН в 200 мл этанола. В первые 2 ч внутри холодильника возгоняется Сг ( СО) в, который время от времени очищают шпателем в реакционную колбу. По окончании реакции выпавший светло-красный осадок отделяют на стеклянном пористом фильтре G4 от оранжевого раствора, отмывают от щелочи этанолом и сушат в высоком вакууме 15 ч при комнатной температуре. Выход - 17 г. Полученный таким образом продукт хотя и содержит до 50 % К2С03 и НСС К, однако вполне пригоден для проведения реакции обмена лигандов. [25]
Следует также отметить, что для двухзарядных ионов переходных металлов не особенно хорошо выполняются правила о связи размера и заряда с механизмом процесса. В этом случае действуют по меньшей мере два дополнительных фактора. Для Си2 координационный многогранник не является правильным октаэдром, скорее всего две связи его намного длиннее и менее прочны, чем остальные четыре ( см. разд. Как следствие этого возрастает и скорость обмена. Во-вторых, для большинства ионов переходных металлов скорость реакций обмена лигандов находится под влиянием изменения энергии d - электронов, так же как изменения в координации связаны как с координацией в исходном реагенте, так и с координацией в переходном состоянии. Это всегда вызывает увеличение энергии активации и, следовательно, уменьшение скорости, но абсолютная величина этого влияния не связана монотонной зависимостью с атомным номером; чаще она изменяется несистематически при переходе от одного иона к другому. Характер этих процессов будет объяснен позже, когда будет рассмотрено электронное строение переходных металлов ( гл. [26]
Комплексы переходных металлов наряду с ферроценовыми производными представляют, пожалуй, наибольшие возможности для варьирования органического лиганда. Самым простым способом получения их является нагревание соответствующего карбонила металла с ароматическим соединением. Оптимальная температура таких реакций ( идущих с отщеплением СО-групп) равна 120 - 150 С, поэтому необходимо использовать соответственно высококипящие органические растворители. Лучшими оказываются такие донорные растворители, как 2-метоксиэтиловый эфир, ди-я-бутиловый эфир, диоксан и тет-рагидрофуран, а также очень часто и их смеси. Для получения термически неустойчивых соединений, в первую очередь соединений Мо и W, или комплексов с очень реакционноспособными ароматическими лигандами следует применять реакцию обмена лигандов в замещенных металлкарбоиилах ML3 ( CO) 3, где L - донорный лигаид со слабой обратной связью. Реакции замещения L протекают в таком случае гораздо быстрее, чем замена СО-групп. Обмен лигандов можно также значительно ускорить добавкой кислот Льюиса, которые образуют с отщепляющимся лигандом прочный аддукт. Для этих трех методов получения комплексов типа М ( т) - ароматический лиганд) ( СО) 3 далее будет дано лишь по одному примеру. Кроме того, опубликованы подробные обзорные статьи [2-4] о получении и химических свойствах этих металлоорганических соединений. [27]
Страницы: 1 2