Реакция - катионный обмен
Cтраница 1
Реакции катионного обмена у молекулярных сит протекают легко. Они могут осуществляться при комнатной температуре в проточной непрерывной системе или путем повторных обработок. Критическая величина рН зависит от соотношения Si02 / Al203 в молекулярных ситах. [1]
Такое изображение реакций катионного обмена по существу не имеет смысла, так как растворенные в воде электролиты диссоциированы на катионы и анионы, а последние никакого участия в этом рассматриваемом процессе не принимают. Поэтому в дальнейшем изложении реакции ионного обмена приводятся только в ионной форме, за исключением тех случаев, когда обменный ион вступает во взаимодействие с присутствующими в воде ионами, как это, например, имеет место при водород-катионировании и обесселивании воды. [2]
Получение поташа реакцией катионного обмена, Отч. [3]
Получение поташа реакцией катионного обмена, Отч. [4]
Сильнокислотные катиониты вступают в реакцию катионного обмена с растворами солей в нейтральной, щелочной и кислой средах. Среднекислотные катиониты вступают в реакцию в нейтральной среде лишь с катионами солей слабых кислот и сильных оснований, причем полнота обмена возрастает с ростом рН среды. [5]
При этом анионит не способен к реакциям катионного обмена и полностью поглощает анион из фильтруемого раствора кислоты. Когда степень амфотерности равна 100, что возможно при еа0 и ег0, ионит способен только к реакциям катионного обмена. Это означает, что в процессе фильтрования исходного раствора кислоты через регенерированный анионит происходит обогащение фильтрата солями в большем количестве, чем происходит поглощение аниона кислоты. [6]
Таким образом, при натрий-катионировании в результате реакций катионного обмена вместо некарбонатных накипеоб-разователей в воде образуются сернокислый и хлористый натрий - легко растворимые соли, не дающие накипи. [7]
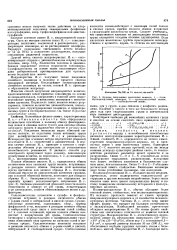 |
Кривые титрования различных ионитов 1 - поли. [8] |
Сильнокислотные катиониты с сульфо - и фосфоно-группами вступают в реакцию катионного обмена с р-рами солей в нейтральной и кислой средах. Слабокислотные катиониты с карбоксильными и оксифенильнымп группами обменивают свои протоны на катионы солей в щелочных средах. Сильноосновные аниониты вступают в реакцию анионного обмена с р-рами солей в кислой, нейтральной и слабощелочной средах. [9]
Катиониты содержат также функциональные группы, водород которых способен к реакциям катионного обмена: сульфогруппы - SOsH; карбоксильные - СООН; фосфорнокислые - РОзРЬ; гидроксильные - ОН. [10]
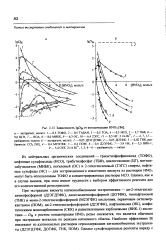 |
Зависимость lg. Bi т концентрации НМОз. [11] |
Bi с ростом концентрации HNOj резко снижается, что является обычным при экстракции металлов по реакции катионного обмена. [12]
При появлении амфотерности это равенство нарушается и ен становится больше еа за счет того, что часть ионов водорода исходной кислоты начинает вступать в реакцию катионного обмена. [13]
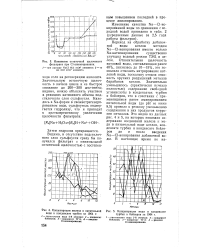 |
Изменение остаточной щелочности.| Концентрация железа в питательной [ IMAGE ] Концентрация меди в конденсате. [14] |
Значительную остаточную щелочность в начале цикла и ее быстрое снижение до 200 - 300 мкг-экв / кг, видимо, можно объяснить участием в реакциях катионного обмена подстилочного слоя сульфоугля. [15]
Страницы: 1 2