Реакция - гомомолекулярный обмен
Cтраница 1
Реакции гомомолекулярного обмена также относятся к числу сложных реакций изотопного обмена. [1]
 |
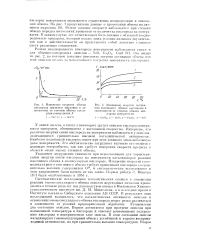
Корреляция между энергией активации реакций и теплотой десорбции кислорода для окислов элеметов 4-го периода. [2] |
Для реакций гомомолекулярного обмена кислорода, окисления метана и окисления водорода коэффициент а равен 0 9; 0 5 и 0 3 соответственно. [3]
Интересно сравнить скорость реакции гомомолекулярного обмена со скоростью обмена молекулярного кислорода с кислородом поверхности окисла. Это сопоставление затрудняется тем, что кислород поверхности многих окислов неоднороден. Так, в случае NiO, Co304, MnOa, GuO наблюдается резкое уменьшение скорости гетерообмена при степени обмена порядка нескольких процентов от количества кислорода на поверхности. Для этих окислов скорость гомомолекулярного обмена сравнивалась о максимальной, начальной скоростью изотопного обмена с кислородом поверхности катализатора. [4]
Систематические исследования каталитических свойств в отношении реакции гомомолекулярного обмена окислов переходных металлов проводились в течение ряда лет под руководством автора в Московском Химико-технологическом институте им. [6]
Обсудим в заключение причины низкой энергии активации реакции гомомолекулярного обмена. [7]
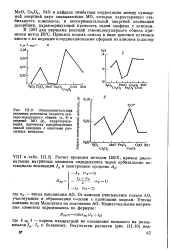 |
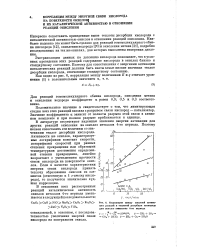
Экспериментальные значения константы скорости дей-теро-водородного обмена ( а, б и энергий МО ( в, характеризующих прочность адсорбционных связей водорода с окислами различных металлов. [8] |
МО, которая характеризует стабильность комплекса, и экспериментальной энергией активации десорбции, характеризующей прочность связи олефина с окислом. В [59] для изучения реакций гомомолекулярного обмена применен метод ИРС. [9]
Интересно сопоставить приведенные выше теплоты десорбции кислорода с каталитической активностью окислов в отношении реакций окисления. Наиболее надежно это может быть сделано для реакций гомомолекулярного обмена кислорода [12], окисления водорода [20] и окисления метана [21], подробно исследованных на тех же окислах, для которых выполнены измерения давления. [10]
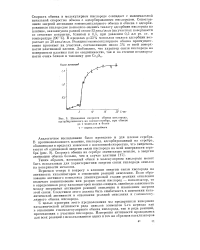 |
Изменение скорости обмена кислорода. [11] |
Скорость обмена в молекулярном кислороде совпадает с максимальной начальной скоростью обмена с адсорбированным кислородом. В пределах до 25 % монослоя теплота адсорбции возрастает до 28 ккал / молъ. Реакция гомомолекулярного обмена преимущественно протекает на участках, составляющих около 3 % от всей поверхности платиновой пленки. [12]
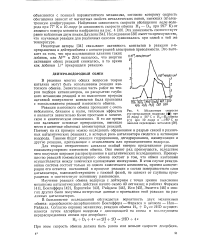 |
Абсолютные скорости о-я-превращения водорода ( при 10 торр и 26 С и Н3 - О2 - обмена ( О при 10 торр и - 196 С на окислах переходных металлов. [13] |
Для теории гетерогенного катализа особый интерес представляют реакции гомомолекулярного изотопного обмена. Они имеют ряд преимуществ, вследствие чего получили широкое распространение в каталитических исследованиях. Преимущество реакций гомомолекулярного обмена состоит в том, что обмен изотопами осуществляется между химически одинаковыми молекулами. В этом случае реакционная система состоит только из одного химического компонента, причем концентрация его остается постоянной в процессе реакции и состав поверхностного слоя катализатора, взаимодействующего с газовой фазой, не зависит от глубины превращения и соответствует истинному равновесию. [14]
Важной особенностью ректификации водорода является химическая инертность молекулярного водорода. Выше ( см. раздел 6.7.1) отмечалось, что реакции изотопного обмена с участием молекулярного водорода требуют применения катализаторов. Поэтому и реакции гомомолекулярного обмена водорода ( Hg Н2 - 2НН) также не идут без катализаторов. Для того, чтобы выделить молекулы Н необходимо провести на катализаторе реакцию гомомолекулярного изотопного обмена и подвергнуть ректификации трехкомпонентную смесь, содержащую изотопные разновидности молекул в соотношении, удовлетворяющем условиям изотопного равновесия при температуре реактора, в котором проводится реакция гомомолекулярного обмена. Все это усложняет технологическую схему и увеличивает число разделительных колонн. Тем не менее, благодаря высоким значениям коэффициентов разделения, удовлетворительной кинетике массообмена и относительной простоте процесса ректификации, этот метод был использован для получения тяжелой воды в промышленном масштабе. [15]
Страницы: 1 2