Реакция - образование - аммиак
Cтраница 1
Реакция образования аммиака обратима и идет с выделением тепла. Обычно реакцию проводят при температуре 500 С. [1]
Реакция образования аммиака протекает на поверхности катализатора. Общая поверхность его зерен слагается из внешней и внутренней поверхности, образованной стенками пор, которыми пронизано каждое зерно катализатора. Внутренняя поверхность зерен во много раз больше внешней, поэтому рабочей поверхностью катализатора является главным образом поверхность пор. Синтез аммиака слагается из следующих стадий: диффузии водорода и азота на поверхность катализатора; химической адсорбции их на поверхности; образования молекул аммиака; десорбции NH3 и его обратной диффузии в газовый объем. [2]
 |
Состав газов до и после конверсия коксового газа. [3] |
Реакция образования аммиака обратима, идет с выделением тепла и значительным уменьшением объема. [4]
Реакция образования аммиака в азото-водородной смеси начинается при потенциале появления молекулярных ионов азота. Ускорение реакции наблюдается при образовании атомарных ионов и атомов азота. [5]
Реакция образования аммиака экзотермична, реакция распада NH3 эндотермична. Повышение температуры, согласно принципу Ле-Шателье, будет увеличивать скорость эндотермической реакции: система как бы сопротивляется нагреванию. Поэтому равновесие сместится в сторону большего распада аммиака и уменьшения той константы равновесия, для которой парциальное давление PSTH3 стоит в числителе. [6]
Реакция образования аммиака зкзотермична, реакция распада NH3 эндотермична. Повышение температуры, согласно принципу Ле Шателье, будет увеличивать скорость эндотермической реакции: система как бы сопротивляется нагреванию. Поэтому равновесие сместится в сторону большего распада аммиака и уменьшения той константы равновесия, для которой парциальное давление рун, стоит в числителе. [7]
Реакция образования аммиака - обратимая, идет с выделением тепла, из четырех молекул газа образуются две молекулы аммиака, поэтому высокое давление благоприятствует смещению равновесия реакции в правую сторону. [8]
Скорость реакции образования аммиака из азота и водорода с повышением температуры растет, в то время как содержание аммиака в равновесной газовой смеси с повышением температуры уменьшается. Температура, при которой скорость образования аммиака является оптимальной в условиях промышленного процесса синтеза, зависит от свойств применяемого катализатора и чистоты азотоводородной смеси. Чем выше активность катализатора, тем ниже температура, при которой процесс может протекать с достаточной скоростью. [9]
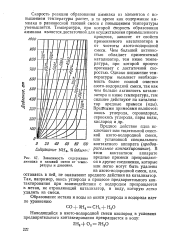 |
Зависимость содержания аммиака в газовой смеси от температуры и давления. [10] |
Скорость реакции образования аммиака из элементов с повышением температуры растет, в то время как содержание аммиака в равновесной газовой смеси с повышением температуры уменьшается. [11]
 |
Схема производства синтетического аммиака. [12] |
С, Реакция образования аммиака идет с выделением теплоты. Поэтому азото-водородную смесь нагревают только перед пуском всей системы. Для этого служит помещенный внутри аппарата нагреватель в виде спирали из проволоки, соединенный с источником электрического тока. [13]
Повышение температуры не благоприятствует реакции образования аммиака ( разд. [14]
Повышение температуры не благоприятствует реакции образования аммиака. [15]
Страницы: 1 2 3 4