Реакция - образование - аммиак
Cтраница 2
Вычислите, как изменяется скорость реакции образования аммиака из N2 и Н2 с увеличением давления в 3 раза. [16]
Согласно принципу смещения равновесия, протеканию реакции образования аммиака способствует увеличение полного давления. [17]
Почему, несмотря на то, что реакция образования аммиака из азота и водорода экзотермическая, синтез аммиака требует повышения температуры до 450 - 500 С. [18]
В результате в стандартных условиях должна протекать реакция образования аммиака. Однако в этих условиях скорость реакции недостаточна. [19]
С другой стороны, зная, что реакция образования аммиака экзотермична, можно было бы повысить его выход за счет сниже-ния-температуры процесса синтеза. Но даже наиболее активные катализаторы не создают промышленно выгодных условий при температурах более низких, чем 400 С. Образующийся аммиак отделяется от оставшихся водорода и азота, которые после прибавления необходимого количества свежей их смеси возвращаются в производство. [20]
Тем не менее даже при наиболее выгодных условиях реакция образования аммиака не идет без катализатора. Многие вещества ускоряют реакцию синтеза аммиака, но большинство из них не удовлетворяет требованиям, предъявляемым к промышленным катализаторам. [21]
В процессе синтеза аммиака инерты накапливаются и тормозят реакцию образования аммиака. Чтобы обеспечить допустимое содержание инертов, часть циркулирующего газа выводится из системы. [22]
Работами многих химиков, производивших опытные исследования над реакцией образования аммиака в присутствии катализаторов, были достигнуты выходы аммиака, не имеющие никакого технического значения. [23]
Однако при пониженных температурах в значительной степени уменьшается скорость реакции образования аммиака. Оптимальную для определенного катализатора температуру устанавливают в зависимости от времени пребывания газа в зоне кон. [24]
Кэрисс и Райдил [21] я Бритт [4], применяя медленные электроны, установили, что реакция образования аммиака в азото-аодородной смеси начинается при потенциале появления молекулярных ионов азота. [25]
В задачах по производству синтетического аммиака чаще всего рассчитывается уменьшение объема газовой смеси за счет реакции образования аммиака, производительность катализатора, его объем и объемная скорость газа. [26]
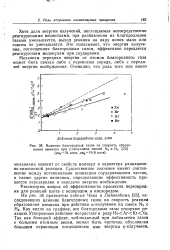 |
Влияние благородных газов на скорость образования аммиака при у-облучении смесей N2 и Н2 ( pN234 атм, рнг14 6 атм. [27] |
На рис. 38 приведены данные Чика и Лайненбома [23], исследовавших влияние благородных газов на скорость реакции образования аммиака при действии а-излучения на смеси NJ с На. Как видно на графике, все благородные газы ускоряют реакцию. Ускоряющее действие возрастает в ряду НеАгКгХе. Так как больший эффект, наблюдаемый при добавлении газов с большим атомным весом, может быть частично обусловлен большим первичным поглощением ми энергии - кзлучвния. [28]
GNHS - концентрация Н2, связанная с термическим разложением N2H4 и NH3 соответственно; н тез - концентрация Н2, затрачиваемая на реакцию образования аммиака. [29]
Таким образом, исследованиями многих химиков, произведенными до 1913 года и теми, которые были произведены до сих пор установлено, что 1) реакция образования аммиака протекает весьма медленно при низких температурах, 2) высокие температуры ( выше 400) способствуют ускорению распада молекулы ам миака, 3) катализаторы действуют ускоряюще на процесс образования аммиака, и лучшие винходы его получаются тогда, когда реагирующие газы находятся под высоким давлением. [30]
Страницы: 1 2 3 4