Реакция - образование - сероуглерод
Cтраница 2
Такой избыток полезен и способствует повышению производительности реактора. Это объясняется тем, что ввиду равновесного характера реакции образования сероуглерода ( см. стр. [16]
Важно не только выдерживать равномерность поступления серы в реторты при стационарном режиме, но и вовремя регулировать подачу ее в соответствии с изменениями перерабатывающей способности слоя древесного угля. Последняя часто меняется в зависимости от многих факторов и, в первую очередь, от нагрева реторт, так как всякое изменение температурных условий внутри реторты увеличивает или сокращает зону реакции и влияет на скорость реакции образования сероуглерода. [17]
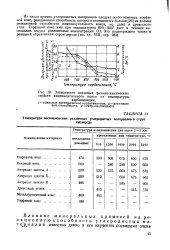 |
Зависимость основных физико-химических свойств каменноугольного кокса от температуры. [18] |
Из числа прочих углеродистых материалов следует особо отметить торфяной кокс, реакционная способность которого оказывается больше [26] не только реакционной способности каменноугольного кокса, но даже и древесного угля. Торфяной кокс уже при температурах 800 - 900 дает в течение нескольких секунд равновесные концентрации СО. Это подтверждено также и реакцией образования сероуглерода ( см. гл. [19]
Пары серы, нагретые до температуры реакции, являются взвешивающей средой. Проходя через кипящий слой гранул угля, они значительно интенсивнее ( в сотни раз) перемешиваются и контактируют с твердой фазой, чем в неподвижном фильтрующем слое. Во всем кипящем слое гранул быстро устанавливается одинаковая температура, что особенно важно для такого плохо проводящего тепла материала, как уголь. В реакции образования сероуглерода из твердого углеродистого материала большую роль играют диффузионные процессы, которые в условиях кипящего слоя протекают намного быстрее. Слой псевдоожиженных гранул углеродистого материала легко перемещается из одного аппарата в другой, что облегчает герметизацию аппаратуры и автоматизацию процесса. [20]
Многие авторы, изучая взаимодействие твердых углеродистых материалов с кислородом, водяным паром, оксидом углерода, доказали, что на их реакционную способность большое влияние оказывает внутренняя поверхность. Справедливо предполагалось, что и на тиореакционную способность углей также большое влияние оказывает их пористая структура. Следовало определить, участвует ли в реакции образования сероуглерода внутренняя поверхность твердого углеродистого материала, и если да, то как изменяется его пористая - структура в процессе выгорания угля в парах серы. [21]
Механизм каталитического действия солей щелочных металлов еще не ясен. Работами Вибо [54-56] и Юца [57], проверенными впоследствии Марковским [48], установлено, что при нагревании до 600 С березового угля с серой в запаянной ампуле часть серы удерживается на угле и не извлекается при экстракции толуолом. Опыты показали, что если уголь после удаления из него экстрагируемой серы нагревать до 900 - 1000 С, то при этом действительно выделяется некоторое количество сероуглерода, который мог получиться только из связанной углем серы. На основании этого Марковский сделал предположение, что каталитические добавки облегчают распад и удаление промежуточных сернистых соединений с поверхности угля. Более быстрая очистка реагирующей поверхности угля способствует увеличению скорости реакции образования сероуглерода. [22]
 |
Каталитическое влияние минеральных примесей в угле на реакцию образования сероуглерода при 1173 К. [23] |
Механизм каталитического действия солей щелочных металлов еще далеко не ясен. Вибо и Юц установили, что при нагревании до 873 К березового угля с серой в запаянной ампуле часть серы удерживается на угле и не извлекается при экстракции толуолом. Опыты показали, что если уголь после удаления из него экстрагируемой серы нагревать до 1173 - 1273 К, то при этом действительно выделяется некоторое количество сероуглерода, которое могло получиться только из связанной углем серы. На основании этого Марковский сделал предположение, что каталитические добавки облегчают распад и удаление промежуточных сернистых соединений с поверхности угля. Более быстрая очистка реагирующей поверхности угля способствует увеличению скорости реакции образования сероуглерода. [24]
Страницы: 1 2