Реакция - окисление - аммиак
Cтраница 2
Реакция окисления аммиака па платиновом катализаторе начинается при температуре 145 - 150 С, При дальнейшем - повышении температуры степень контактирования растет; одновременно возрастает скорость реакции аммиака с кислородом. [16]
Реакцию окисления аммиака до окислов азота могут ускорять не только шгатина, но и другие катализаторы, например окислы железа, марганца, кобальта и другие окислы, характеризующиеся электронными свойствами. [17]
Поскольку реакция окисления аммиака явлщгся экзотермической, смесь быстро нагревается. Максимальный выход окиси азота составляет, около 98 % от теоретического. Получение азотной кислоты из окиси азота в дальнейшем сводится к окислению NO до NO2 и растворению последней в воде. [18]
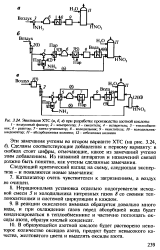 |
Эволюция ХГС ( а, б, в при разработке производства азотной кислоты. [19] |
В реакции окисления аммиака образуется довольно много воды, и при охлаждении газов перед абсорбцией вода будет конденсироваться в теплообменнике и частично поглощать оксиды азота, образуя кислый конденсат. [20]
 |
Принципиальная схема контактного аппарата для производства азотной кислоты под атмосферным давлением. [21] |
По реакции окисления аммиака до окиси азота на 4 молекулы аммиака теоретически необходимо затратить 5 молекул кислорода или на 1 моль аммиака 1 25 моль кислорода. Для увеличения выхода окиси азота и повышения скорости реакции окисления аммиака практически берут на 1 моль аммиака 1 7 - 2 моль кислорода. Указанному отношению отвечает содержание примерно 10 - 12 % аммиака в исходной аммиачно-воздушной смеси. Кислород необходим не только для окисления аммиака, но и на дальнейшее окисление окиси азота до двуокиси. [22]
Поскольку реакция окисления аммиака является экзотермической, смесь быстро нагревается. Максимальный выход оксида азота составляет около 98 % от теоретического. Получение азотной кислоты из оксида азота в дальнейшем сводится к окислению NO до NO2 и растворению последней в воде. [23]
Эта реакция окисления аммиака сопровождается выделением тепловой энергии - проволочка нагревается до красного каления. [24]
Почему реакция окисления аммиака кислородом практически необратима. [25]
Но реакция окисления аммиака может протекать и по другому нежелательному пути, приводящему к образованию молекулярного азота и воды ( 4NH3 3O2 2N2 6Н2О 303040 кал. [26]
Почему реакция окисления аммиака кислородом практически необратима. [27]
После реакции окисления аммиака нитрозные газы с температурой 1073 - 1093 К поступают в котел-утилизатор 15 для получения пара давлением 10 - 12 - 105 Па за счет утилизации тепла реакции. В результате получения пара температура нитрозных газов снижается с 1073 до 443 К - Для дальнейшего охлаждения нитрозные газы поступают в холодильник 17, по трубкам которого циркулирует охлаждающая вода. В отходящих нитрозных газах должно содержаться кислорода не менее 5 об. %, поэтому после газового холодильника непосредственно в газоход нитрозных газов через вентилятор 16 подается дополнительно воздух для обеспечения окисления NO в NO2 в абсорбционной зоне. [28]
Почему реакция окисления аммиака кислородом практически необратима. [29]
Но реакция окисления аммиака может протекать и по другому нежелательному пути, приводящему к образованию молекулярного азота и воды ( 4NH3 ЗО2 2N2 6Н2О 303040 ал. [30]
Страницы: 1 2 3 4