Реакция - окисление - сернистый ангидрид
Cтраница 1
Реакции окисления сернистого ангидрида и аммиака, синтеза аммиака из азота и водорода не могут идти с необходимой для производства скоростью без применения катализаторов. Таким образом, катализаторы, ускоряя соответствующие реакции в миллионы раз, обеспечивают возможность промышленного производ-ства аммиака, азотной и серной кислот. [1]
Реакция окисления сернистого ангидрида в серный обратима. [2]
Скорость реакции окисления сернистого ангидрида зависит и от того, насколько контактирование приблизилось к своему пределу. [3]
Так как реакция окисления сернистого ангидрида окислами азота протекает с достаточной скоростью только в серной кислоте сравнительно низкой концентрации ( около. [4]
Энергия активации реакции окисления сернистого ангидрида в серный настолько значительна, что в отсутствии катализаторов ( гомогенное окисление) она практически не идет, даже если температура достигает высоких значений. [5]
В обычных условиях реакция окисления сернистого ангидрида протекает очень медленно, поэтому в промышленности для ускорения процесса проводят эту реакцию на катализаторе или применяют в качестве передатчика кислорода нитрозу. В зависимости от этого различают контактный и нитрозный ( башенный) способы производства серной кислоты. [6]
В обычных условиях реакция окисления сернистого ангидрида протекает очень медленно, поэтому в промышленности для ускорения процесса проводят эту реакцию на катализаторе или применяют в качестве передатчика кислорода нитрозу. В зависимости от этого различают контактный и нитрозный ( башенный) способы производства серной кислоты. Удельный вес получения серной кислоты нитрозным способом в общем объеме производства серной кислоты очень мал ( 5 %) и будет уменьшаться дальше, поэтому этот способ в книге не рассматривается. [7]
Однако тепловой эффект реакции окисления сернистого ангидрида удалось записать лишь после того, как для уменьшения потерь тепла реакции на нагревание катализатора количество последнего было уменьшено до 4 мл против принятых в стандартных условиях 10 мл. [8]
Из написанного выше уравнения реакции окисления сернистого ангидрида видно, что она является равновесной, гетерогенной экзотермической реакцией и идущей с уменьшением объема. [9]
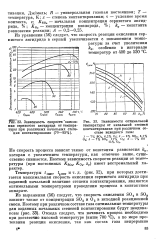
С другой стороны, скорость реакции окисления сернистого ангидрида возрастает с температурой. Так, если сопоставлять теоретический процент контактирования, достигаемый при разных температурах с соответствующими им скоростями реакций, то из данных, приводимых в таблице ( 6) видно, что увеличение скорости реакции с повышением температуры значительно опережает снижение процента контактирования. В данной таблице скорость окисления SO2 при 425 С принята за единицу. [10]
Контактный способ основан на рассмотренной выше реакции окисления сернистого ангидрида в присутствии катализаторов. [11]
Вероятно, температура не оказывает заметного влияния на скорость реакции окисления сернистого ангидрида под действием радиации, тем не менее изменение температуры опытов от 0 до 100 С может быть желательным. [12]
 |
Зависимость скорости окисле - [ IMAGE ] Зависимости оптимальной. [13] |
Из уравнения ( 56) следует, что скорость реакции окисления сернистого ангидрида в серный увеличивается с повышением температуры за счет увеличения / сс, особенно в интервале температур от 400 до 550 С. [14]
При малых избытках воздуха и идеальном перемешивании топлива с воздухом реакция окисления сернистого ангидрида сдерживается концентрацией кислорода. При этом предполагается, что цепные реакции углеводородной части топлива близки к завершению. [15]
Страницы: 1 2 3