Реакция - окисление - металл
Cтраница 1
Реакции окисления металлов составляют основу процессов огневого рафинирования. [1]
 |
Отношение металлов к простым веществам - окислителям. [2] |
Реакции окисления металлов относятся к топохимическим реакциям ( см. разд. [3]
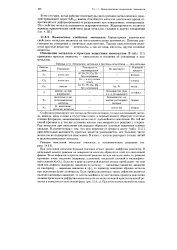
 |
Схема гетерогенной реакции окисления металла. [4] |
Реакции окисления металла ( жидкого или твердого) кислородом из газовой атмосферы представляют собой гетерогенные процессы, равновесие которых определяется правилом фаз. [5]
Реакция окисления металла водяным паром, приводящая к образованию окисла и гидрида, также представляет интерес, однако нет никаких точных термодинамических данных о гидридах этих металлов. [6]
Реакции окисления металлов характерны для всех разновидностей сварки плавлением. Окисление основного металла или легирующих элементов в процессе сварки - явление нежелательное, но, тем не менее, всегда имеющее место на практике. Оно сопровождается выделением определенного количества тепла, которое может играть заметную роль в тепловом балансе процесса сварки. [7]
Движущей силой реакции окисления металла кислородом является изменение свободной энергии системы, обусловленное образованием оксида в результате химической реакции. Таким образом, свободная энергия системы кислород - металл должна быть больше свободной энергии оксида металла, только в таком случае возможно окисление металла. [8]
Экзотермический характер реакции окисления металла обусловливает выделение дополнительного количества теплоты, необходимого для снижения вязкости образующихся окислов и поддержания непрерывности процесса резки. [9]
К топо-химическим относятся реакции окисления металлов и восстановления их из оксидов, термического разложения других солей, некоторые реакции замещения и окисления. [10]
Имеются в виду реакции окисления металла. [11]
При химической коррозии реакции окисления металлов проходят в отсутствие гальванических пар. Поэтому химическая коррозия может протекать в среде нефтепродуктов и других типичных неэлектролитов. Коррозионноагрессивными агентами в этом случае являются сильные окислители в совокупности с веществами, разрушающими защитные пленки на поверхности металлов. [12]
После начала растрескивания окалины скорость реакции окисления металла обычно становится линейной функцией времени. При этих условиях часто бывает очень трудно установить промежуточный процесс, определяющий скорость суммарной реакции, и этот вопрос является предметом больших споров. [13]
В этом случае дополнительная энергия химнч-а-ской реакции окисления металла делает плазменный процесс энергетически более рациональным. [14]
Подобным же образом могут быть рассмотрены реакции окисления металлов в водных растворах кислот. VII, § 4) рассмотрена схема взаимодействия металлов с водными растворами кислот и сделан вывод, что металл взаимодействует с кислотой, если энергия ионизации его атома меньше энергии ионизации атома водорода, однако дальше указано, что ход реакции осложняется гидратацией водородного и металлического ионов. [15]
Страницы: 1 2 3 4